Questões de Concurso
Foram encontradas 3.145 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Para essas moléculas, as geometrias espaciais são, respectivamente,
Cgrafite + O2 (g) → CO2 (g) ∆H = – 393,5 kJ mol–1
Cdiamante + O2 (g) → CO2 (g) ∆H = – 395,4 kJ mol–1
Qual a variação de entalpia necessária, em quilojoules para converter um mol de grafite em diamante?
Nesse contexto, em uma previsão de polaridade, sabe-se que é apolar a molécula
Um isômero constitucional do isopreno é o
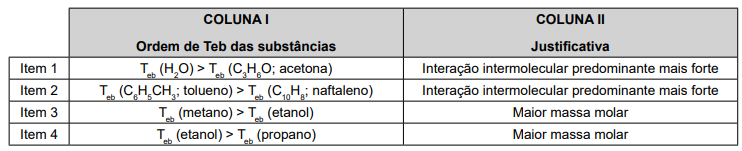
Considerando a relação entre a COLUNA I e a COLUNA II, qual item está correto?
Em relação aos processos eletroquímicos, julgue o item a seguir.
Toda célula eletroquímica é caracterizada por uma diferença
de potencial ou força eletromotriz que, em condições padrão,
é estimada a partir dos potenciais-padrão de redução de cada
semirreação, subtraindo-se o potencial-padrão de redução do
processo catódico do potencial-padrão de redução do
processo anódico.
Em relação aos processos eletroquímicos, julgue o item a seguir.
Na proteção catódica de dutos metálicos com base de ferro, o
duto é conectado mediante cabeamento elétrico a outro metal
mais fortemente oxidante, denominado de ânodo de
sacrífico.
No que se refere às reações de oxirredução, julgue o item que se segue.
As seguintes equações são exemplos corretos de semirreações de oxirredução.
Ce+4 + e− → Ce3+
Fe+2 → Fe3+ + e−
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Se não existir matéria como meio de propagação, não é
possível a transferência de calor.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
A capacidade térmica de um corpo consiste na quantidade de
calor que ele necessita ceder ou receber para variar sua
temperatura em 1 grau, sendo diretamente proporcional
à sua massa.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Além dos estados sólido, líquido e gasoso, há o plasma, que
é a condição da matéria associada a partículas muito
energizadas, com certo distanciamento e nenhuma ou pouca
ligação entre si, e cujas propriedades são semelhantes às do
estado líquido, mas com uma energia cinética maior.
Considerando que a estequiometria tem base em leis ponderais e compreende cálculos e regras para determinar a correta proporção das substâncias que se pretende utilizar, julgue o item a seguir.
Os coeficientes estequiométricos em uma reação química
podem ser determinados por tentativas; nesse caso, a fim de
melhorar a assertividade, são utilizadas algumas regras
empíricas, por exemplo, aquela em que se balanceiam, por
último, o carbono, o hidrogênio e o oxigênio, nessa ordem.

Disponível em: https://www.tabelaperiodica.org/
Considerando apenas a composição mencionada, a reciclagem dessas novas lâmpadas traria vantagens porque:
4 Au(minério) + 8 NaCN(aq) + O2(g) + 2 H2O(l) → 4 Na[Au(CN)2](aq) + 4 NaOH(aq)
A espécie química solúvel [Au(CN)2]− é posteriormente imobilizada sobre carvão ativado, e o ouro é recuperado por redução eletroquímica:
[Au(CN)2]−(aq) + e− → Au(s) + 2 CN−(aq)
Dados: Massa molar (g mol−1): Au = 197, NaCN = 49.
Considerando a estequiometria das reações, qual é a massa de ouro que se espera extrair, utilizando-se 1 kg de cianeto de sódio?
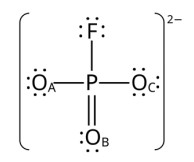
Ao se calcular as cargas formais de cada átomo na estrutura apresentada, conclui-se que são nulas, com exceção dos átomos:
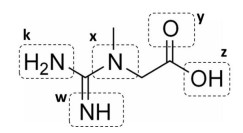
Em pH = 11,0, qual átomo estará carregado negativamente, formando uma espécie química iônica?
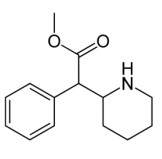
Considerando a estrutura química apresentada, assinale a alternativa correta.
Foi inventada por Alessandro Volta, que publicou seus experimentos em 1799 e é considerado o criador das pilhas elétricas, que desencadeou os diversos avanços no ramo da eletroquímica.
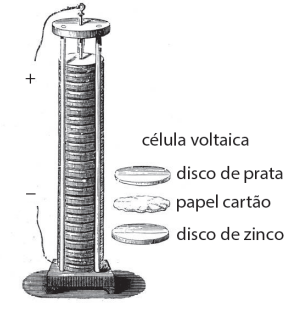
O dispositivo é feito de diversas camadas dos metais zinco e prata, separadas por um disco de material poroso embebido numa solução de sal, conforme representado pela figura ilustrada:
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) a respeito dessa descoberta.
( ) Os discos de zinco constituem o ânodo (oxidação) e os discos de prata constituem o cátodo (redução).
( ) A passagem de elétrons, no circuito externo, é do cátodo para o ânodo.
( ) Os discos de zinco sofrem corrosão com o funcionamento da pilha, cuja semirreação é: Zn(s) ➔ Zn2+ + 2 e– .
( ) O aumento do diâmetro dos discos não influencia a tensão fornecida pela pilha.
( ) Os discos de zinco são fontes de elétrons para o circuito externo.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Qual a quantidade de água, em mL, que deverá ser adicionada para que a concentração do soluto seja reduzida para 0,04 mol/L?
No gráfico abaixo estão representados os caminhos de uma reação com catalisador e uma sem catalisador.
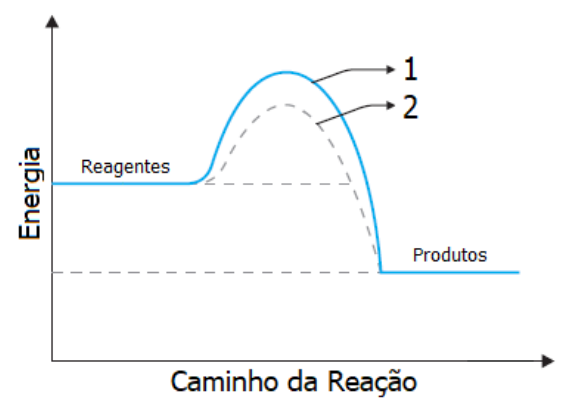
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com base nesse gráfico.
( ) A curva 1 refere-se à reação não catalisada e a curva 2 refere-se à reação catalisada.
( ) A energia de ativação da curva 1 é maior do que a da curva 2.
( ) A utilização de um catalisador na reação aumenta o valor de ∆H.
( ) O complexo ativado da curva 1 apresenta a mesma energia do complexo ativado da curva 2.
( ) Se a reação seguir o caminho da curva 2, ela será mais rápida.
Assinale a alternativa que indica a sequência correta,
de cima para baixo.