Questões de Concurso
Foram encontradas 3.145 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Assinale a alternativa em que é descrito corretamente o funcionamento de um espectrômetro de massa com ionização por impacto de elétrons associado a um cromatógrafo gasoso.
As4O6 + 6 H2O 4 H3AsO3
H3AsO3 + I3- + H2O H3AsO4 + 3 I- + 2 H+ →→
Calcule a molaridade da solução de I3¯.
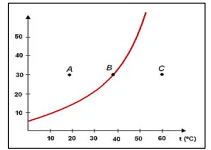
(Disponível em: https://brasilescola.uol.com.br/quimica/saturacao-dassolucoes.htm. Acesso em: 29/01/2023.)
Com base nessas informações, julgue o próximo item.
A etapa II do mecanismo proposto, em que a molécula de
ozônio reage com o oxigênio atômico, é bimolecular.
Com base nessas informações, julgue o próximo item.
Se a taxa de produção de oxigênio (d[O2]/dt) for igual a
3,0 × 10−5 mol/s, a taxa de consumo de ozônio (d[O3]/dt)
será igual a −2,0 × 10−5 mol/s.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O modelo atômico de Bohr permitiu a Mendeleev
estabelecer a tabela periódica.
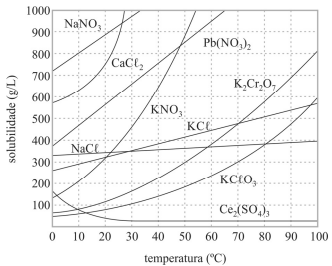
Considere-se que uma solução de nitrato de sódio (NaNO3) tenha sido preparada a 20 °C, dissolvendo-se 1,00 mol de NaNO3 em 100 mL de água, e que, posteriormente, esse sistema tenha sido resfriado a 10 °C. Nesse caso, a massa do precipitado formado é superior a 40 g.

As dissoluções dos sais apresentados no gráfico são processos endotérmicos.
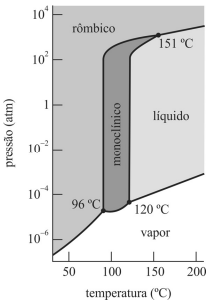
Quando submetido à pressão de 1 atm e à temperatura de 170 °C, o enxofre está na fase sólida.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.
A adição de sal light à água, para o preparo de macarrão, diminui a temperatura de ebulição e aumenta a pressão máxima de vapor d’água, por isso ela ferveria mais rápido nessas condições.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A concentração de íons Cl−
na solução de sal light preparada
conforme o texto é inferior a 0,05 mol/L.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
O cloreto de sódio é um composto iônico de estrutura cúbica
de face centrada, com número de coordenação igual a 6 para
cada íon.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
Na solução de sal light preparada conforme o texto, estão
contidos 1,2 × 1022 íons de Na+
.