Questões de Concurso
Para prefeitura de teresina - pi
Foram encontradas 3.150 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A figura abaixo mostra uma carta de controle de Shewhart para medidas de pH de uma solução com pH igual a sete. A carta de controle mostra os resultados das médias de várias medições realizadas.
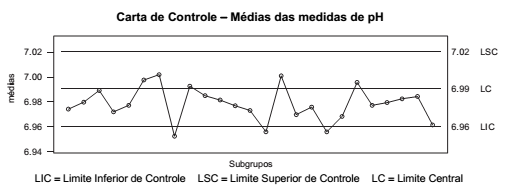
Sobre o gráfico apresentado, considere:
I. O processo de medição para este valor de pH (7,0) nas condições estabelecidas está sob controle estatístico.
II. O gráfico de médias apresenta tendência descendente em relação ao Limite Central.
III. Ações corretivas devem ser feitas para eliminação das causas comuns ou aleatórias que resultaram em pontos fora dos limites de controle.
Está correto o que consta APENAS em
A resolução n° 430 de 2011 do Conselho Nacional do Meio Ambiente − CONAMA dispõe sobre as condições e padrões de lançamento de efluentes. De acordo com o seu Artigo 16, os efluentes de qualquer fonte poluidora somente poderão ser lançados diretamente no corpo receptor se obedecerem às condições e padrões previstos no referido artigo.
Para condições de lançamento de efluentes, o pH deve estar entre
Durante o processo de filtração o fenômeno conhecido como transpasse ocorre quando há um aumento gradativo da turbidez da água filtrada com o passar do tempo. Considere:
I. O transpasse ocorre quando as forças de cisalhamento que agem sobre as partículas são maiores que as forças de adesão entre essas partículas e o meio filtrante.
II. Quando ocorre o transpasse nos processos de filtração de fluxo descendente, haverá o arrastamento das partículas para as camadas superiores do meio filtrante.
III. O transpasse é um indicador de aumento da eficácia do meio filtrante.
Está correto o que consta APENAS em
A figura abaixo representa um Reator Anaeróbio de Fluxo Ascendente.
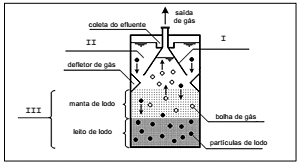
As partes no desenho identificadas como I, II e III, correspondem, correta e respectivamente, a:
Na determinação da Demanda Química de Oxigênio − DQO de uma amostra de um efluente doméstico, 50 mL da amostra foram aquecidos por 2 horas, sob refluxo, com 30 mL de solução padronizada de K2Cr2O7 0,030 mol/L, na presença de H2SO4 concentrado. Após o aquecimento a amostra foi titulada com solução padronizada de FeSO4 0,060 mol/L, consumindo-se 25 mL desta solução.
Dados:
Massas molares (em g/mol):
K = 39 O = 16 S = 32 Fe = 56 Cr = 52 H = 1
Estequiometricamente:
1,0 mol de K2Cr2O7 equivale a 1,5 mols de gás O2.
1,0 mol de K2Cr2O7 equivale a 6 mols de FeSO4.
A DQO da amostra calculada, em mg/L de gás O2, é
O sistema de filtração denominado ..I.. baseia-se em um processo mecânico que tem como objetivo a desidratação do lodo. É constituído por placas dispostas de forma sequencial onde são colocados os elementos filtrantes. No processo, o lodo é bombeado, forçando a passagem do líquido, sob pressão, pelo meio filtrante, onde os sólidos são retidos.
A lacuna I é preenchida corretamente por
Considere as 6 estruturas abaixo.
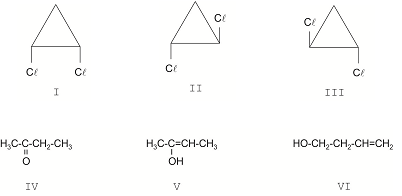
Em relação à isomeria é INCORRETO afirmar que
“O cromo pode ser liberado para o ambiente por meio de resíduos originados de um amplo número de processamentos industriais, incluindo a indústria curtumeira, têxtil e de metalurgia do ferro, aço e outros metais. Dentre as formas normalmente encontradas na natureza, o cromo hexavalente apresenta-se como cromatos e dicromatos (CrO42- e Cr2O72- ), os quais são tóxicos e mutagênicos, solúveis em uma ampla faixa de pH e geralmente móveis no sistema solo/água. O cromo trivalente apresenta-se na forma do cátion Cr3+ e do ânion CrO2- , sendo consideravelmente menos tóxico e de baixa mobilidade, em razão de sua precipitação como óxidos e hidróxidos em pH superior a 5,0.”
Um dos processos de transformação do cromo hexavalente tóxico em cromo trivalente menos tóxico, é a reação destes compostos com ferro puro ou cátion Fe2+ como mostram as reações abaixo (a 25 ºC e 1 atm).
Fe(s) + CrO42−(aq) + 4H2O(l)  Fe(OH)3(s) + Cr(OH)3(s) + 2OH−(aq)
Fe(OH)3(s) + Cr(OH)3(s) + 2OH−(aq)
6Fe2+(aq) + Cr2O72−(aq) + 14H+  6Fe3+(aq) + 2Cr3+(aq) + 7H2O(l)
6Fe3+(aq) + 2Cr3+(aq) + 7H2O(l)
Dados: potenciais de redução em volts (V) a 25 ºC e 1 atm
Fe2+(aq)  Fe3+(aq) + e− E0 = −0,77
Fe3+(aq) + e− E0 = −0,77
Fe0(s)  Fe3+(aq) + 3e− E0 = 0,04
Fe3+(aq) + 3e− E0 = 0,04
CrO42−(aq) + 4H2O(l) + 3e−  Cr(OH)3(s) + 2OH−(aq) E0 = −0,12
Cr(OH)3(s) + 2OH−(aq) E0 = −0,12
Cr2O72−(aq) + 14H+ (aq) + 6e−  2Cr3+(aq) + 7H2O(l) E0 = 1,33
2Cr3+(aq) + 7H2O(l) E0 = 1,33
A hidrólise de sais de alguns metais pode levar à formação de acidez mineral nas águas, como ocorre nas estações de tratamento de águas para abastecimento público, por exemplo, com cloreto de ferro (III) ou sulfato de alumínio, conforme indicado nas equações químicas (I) e (II) abaixo.
(I) Al2(SO4)
3(aq) + 6H2O  2Al(OH)3(s) + 6H+
(aq) + 3SO42- (aq)
2Al(OH)3(s) + 6H+
(aq) + 3SO42- (aq)
(II) FeCl3(aq) + 3H2O  Fe(OH)3(s) + 3H+
(aq) + 3Cl−
(aq)
Fe(OH)3(s) + 3H+
(aq) + 3Cl−
(aq)
Para uma solução com 2 mol.L−1 de sulfato de alumínio e 3 mol.L−1 de cloreto férrico, para reação com 100% de rendimento,
tem-se, em mol.L−1, para as equações (I) e (II), respectivamente,
No processo de tingimento de fibras de nylon, o efluente não tratado do banho de corante na fibra foi preparado com solução
tampão de ácido acético e acetato de sódio, em uma concentração de 0,60 g . e 1,64 g . L−1, respectivamente.
e 1,64 g . L−1, respectivamente.
Dados:
log1 = 0; log0,5 = −0,3 log2 = 0,3
pKa do ácido acético = 4,74
massas molares (g.mol−1): ácido acético = 60; acetato de sódio = 82
O pH estimado do efluente será