Questões de Concurso
Para ufc
Foram encontradas 5.509 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
No planejamento e condução de ensaios clínicos com portadores de câncer, temos:
I. Para a mensuração de sobrevida global, o cegamento do estudo é essencial por ser um desfecho inequívoco.
II. A sobrevida livre de progressão é definida como o tempo entre a randomização e a progressão da doença ou morte do paciente por qualquer causa.
III. Há consenso de que a sobrevida global é o desfecho mais confiável e usualmente o preferido, quando puderem ser conduzidos estudos clínicos para avaliar corretamente a sobrevida, por ser uma medida direta universalmente aceita de benefício clínico do medicamento.
IV. A análise de sobrevida global deve ser feita em estudos controlados e randomizados, pois desfechos dependentes do tempo, como a sobrevida, usualmente não podem ser avaliados de forma confiável em estudos com controles históricos.
V. O tempo até a progressão da doença é definido como o tempo entre a randomização e a progressão da doença. A diferença entre o tempo até a progressão da doença e a sobrevida livre de progressão é que o primeiro não inclui as mortes.
O correto está em:
Considere as seguintes proposições acerca das formas e ou critérios de escolha dos participantes de pesquisa.
I. A população de pessoas que atendem aos critérios de seleção costuma ser grande demais, sendo necessário selecionar uma amostra para estudo.
II. As amostras sistemáticas são suscetíveis a erros induzidos por periodicidades naturais da população e permitem ao investigador prever e, possivelmente, manipular quem entrará na amostra.
III. As subamostras estratificadas podem ser ponderadas para permitir seleção desproporcional de subgrupos menos comum na população, mas que sejam de interesse especial ao investigador.
IV. As amostras de conveniência e as consecutivas são tipos de amostragem probabilísticas.
V. A amostragem por conglomerados é uma amostragem aleatória não probabilística útil em população bastante dispersas, nas quais se torna impraticável listar e amostrar os seus elementos.
O correto está em:
Analise as afirmativas abaixo, referentes aos aspectos financeiros de uma pesquisa.
I. Os aspectos financeiros devem ser registrados em um documento de concordância entre o patrocinador e o pesquisador/instituição de pesquisa.
II. O acordo deve incluir evidência de aceitação/envolvimento da instituição que será sede da pesquisa, quanto à oferta de instalações e serviços, bem como ao pagamento proposto do Patrocinador.
III. Os pesquisadores devem revelar os interesses financeiros envolvidos, conforme solicitado pelas instâncias éticas, patrocinadores, regulatórias e outras.
IV. A revelação de interesses está limitada aos pesquisadores envolvidos diretamente na pesquisa.
O correto está em:
Nos métodos de pesquisa clínica podemos afirmar que:
I. Em um estudo de caso controle, a prevalência de um fator de risco em uma amostra de sujeitos que têm o desfecho de interesse é comparada com a prevalência em uma amostra que não tem.
II. O delineamento de caso-controle aninhado com amostragem por incidência-densidade permite analisar as relações de risco, levando em consideração mudanças ao longo do tempo nos níveis do fator de risco e na disponibilidade do seguimento.
III. Os estudos de coorte podem ser usados para estimar a incidência e a prevalência da doença.
IV. O caso-coorte aninhado pode usar um único grupo-controle para vários estudos.
V. Em um estudo transversal todas as medições são feitas em um único momento, sem período de seguimento.
O correto está em:
Em se tratando de estudos de biodisponibilidade relativa podemos afirmar que:
I. O estudo convencional é do tipo aberto, aleatório, cruzado.
II. Medicamentos citotóxicos não podem ser testados em voluntários sadios, somente em pacientes portadores estáveis da patologia para a qual o medicamento é indicado.
III. Para avaliação da bioequivalência devem ser empregados os parâmetros ASC0-t, Cmax, e Tmax; o parâmetro meia-vida de eliminação (t1/2) do fármaco e/ou metabólito também deve ser determinada, embora não haja necessidade de tratamento estatístico.
IV. Os voluntários participantes dos estudos clínicos, que necessitem de confinamento, deverão permanecer em local apropriado que atenda às Boas Práticas de Clínica (BPC), sob a responsabilidade de profissional médico.
V. O cronograma de coleta das amostras biológicas deverá garantir a adequada caracterização do perfil plasmático do fármaco ou metabólito contemplando um tempo menor ou igual a 3-5 vezes a meiavida de eliminação dos mesmos.
O correto está em:
No que diz respeito ao cálculo do tamanho da amostra para a realização de um ensaio clínico, analise as afirmativas abaixo e marque a alternativa correta.
I. O erro α ou tipo I representa o falso positivo, ou seja, a intervenção não é eficaz, mas, pela análise estatística, ela é apontada como eficaz e pode ser minimizado pelo nível de significância escolhido, normalmente 5%.
II. O erro β ou erro tipo II representa o falso negativo, ou seja, a intervenção é eficaz, mas, pela análise estatística, ela é apontada como não eficaz. O erro tipo β é minimizado indiretamente aumentando o poder do teste, uma vez que o poder é representado por 1 – β.
III. Mesmo considerando os erros tipo I e tipo II, o poder do ensaio clínico randomizado não tem a capacidade de evidenciar a eficácia da intervenção.
IV. O desfecho pode ser medido quantitativamente (números), entretanto, será necessário ter ideia da magnitude de efeito e desvio padrão.
V. O desfecho pode ser medido qualitativamente (com categorias), entretanto será necessário saber qual a proporção de pacientes com desfecho é esperada no grupo da intervenção e qual a proporção de pacientes com desfecho é esperada no grupo controle.
O correto está em:
Considere as seguintes proposições acerca das formas de mensuração da magnitude do efeito em um ensaio clínico. Analise as afirmativas abaixo e, em seguida, assinale a alternativa correta.
I. O risco relativo (RR) é a razão entre o risco do evento de interesse no grupo tratado (RT) e o risco do evento de interesse no grupo controle (RC), ou seja, RR = RT / RC; quando RR é igual a 1 significa que o tratamento não proporcionou benefício clínico.
II. A redução absoluta do risco (RAR) é dada pela diferença entre o risco do evento de interesse no grupo tratado (RT) e o risco do evento de interesse no grupo controle (RC), isto é, RAR = RT – RC.
III. A redução relativa do risco (RRR) denota a redução percentual do evento de interesse no grupo tratado em relação ao grupo controle, sendo também conhecida como eficácia e calculada conforme a expressão: RRR = (1 – RR) x 100.
IV. O número necessário para tratar (NNT) é o inverso da RAR, ou seja, NNT = 1 / RAR; tal medida expressa o número de pacientes que devem ser tratados com a intervenção para que ocorra um evento indesejável.
O correto está em:
A figura abaixo ilustra o gráfico da pressão arterial sistólica (PAS) em função do tempo. Os pontos correspondem aos valores médios da PAS de pacientes hipertensos tratados com dois fármacos antihipertensivos ao longo de 90 dias (D90). No dia zero (D0), efetuou-se a medida basal (pré-tratamento) da PAS.
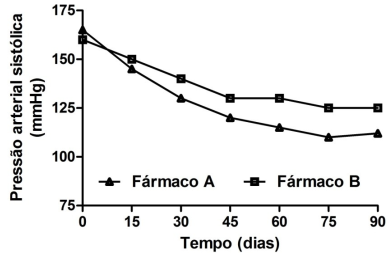
Assinale, dentre os parâmetros abaixo, aquele que avalia, de forma mais apropriada, o efeito anti-hipertensivo
global.
Durante o planejamento do tamanho da amostra de um ensaio clínico, o pesquisador, rotineiramente, atribui para a probabilidade máxima do erro tipo I (α = 5%) um valor menor que o estabelecido para a probabilidade máxima do erro tipo II (β = 20%).
Analise as proposições acerca das razões para tal procedimento e, em seguida, assinale a alternativa correta.
I. É menos grave o risco de atribuir equivocadamente eficácia a um determinado fármaco do que concluir erroneamente que um dado fármaco é ineficaz.
II. O risco de atribuir equivocadamente eficácia a um determinado fármaco é mais grave do que concluir erroneamente que um dado fármaco é ineficaz.
III. Concluir erroneamente que um dado fármaco é ineficaz é tão grave quanto atribuir equivocadamente eficácia a um determinado fármaco.
IV. Um resultado falso-positivo acerca da eficácia de um fármaco é mais prejudicial do que um resultado falso-negativo;
V. Um resultado falso-positivo acerca da eficácia de um fármaco é menos prejudicial do que um resultado falso-negativo.
O correto está em:
Um pesquisador deseja dimensionar a amostra de um ensaio clínico, tomando como base o desfecho primário, que constitui uma variável contínua. Para tanto, ele necessita atribuir valores para os parâmetros utilizados no cálculo, quais sejam: a probabilidade máxima do erro tipo I (nível de significância, α), a probabilidade máxima do erro tipo II (β) e poder estatístico (1 – β), a diferença a ser detectada (magnitude do efeito, δ) e a variabilidade da variável de desfecho (desvio padrão, σ).
Analise as seguintes sentenças acerca da influência de tais parâmetros no tamanho da amostra, e marque a alternativa correta.
I. Quanto maior α, maior o tamanho da amostra.
II. Quanto maior o poder (1 – β), maior o tamanho da amostra.
III. Quanto maior σ, maior o tamanho da amostra.
IV. Quanto maior δ, maior o tamanho da amostra.
V. Quanto maior a razão δ/σ, menor o tamanho da amostra.
O correto está em:
Sabendo-se que os ensaios clínicos aleatorizados são investigações científicas consideradas padrão de excelência em estudos científicos que pretendem avaliar o efeito de um tratamento medicamentoso no curso de uma doença, analise as afirmativas abaixo e marque a alternativa correta.
I. Trata-se de um estudo experimental, onde se isola a contribuição singular de um fator mantendo-se constante, sempre que possível, os outros determinantes do desfecho.
II. Elege-se o tipo de população alvo da intervenção, estabelecendo-se os critérios de elegibilidade (inclusão e exclusão).
III. A alocação aleatória permite a geração de grupos verdadeiramente comparáveis, de modo que cada paciente tem a mesma probabilidade de pertencer a um dos grupos (exposto ou não-exposto), desde que todos preencham os critérios de elegibilidade.
IV. Todos os fatores relacionados ao prognóstico e ao desfecho tendem a ser igualmente distribuídos nos grupos de comparação. Desse modo, eventuais diferenças na ocorrência do desfecho entre os grupos experimental e controle podem ser atribuídas à intervenção.
V. Para a aleatorização ser válida é necessário que cada paciente elegível tenha chance igual de ser alocado para cada um dos grupos do estudo e não pode haver influências dos investigadores.
O correto está em:
Os procedimentos analíticos de um ensaio clínico vão depender da natureza do estudo, dos parâmetros estimados, e dos efeitos que foram medidos. O plano de análise do ensaio clínico deve estar incluído no protocolo. Nesse contexto, julgue os itens a seguir.
I. Em estudos do tipo caso-controle, quando se quer comparar dois grupos mediante de suas respostas em uma variável dicotômica por meio de um aplicativo estatístico, usa-se o teste t de Student.
II. O teste qui-quadrado, serve para verificar se a frequência com que determinado acontecimento observado em uma amostra se desvia significativamente ou não da frequência com que ele é esperado.
III. O risco relativo calculado em um aplicativo estatístico representa uma relação (ratio) da probabilidade de o evento ocorrer no grupo exposto contra o grupo de controle (não exposto), sendo muito utilizado em estudos de caso-controle.
IV. Uma análise de dados mais rigorosa é chamada de intenção de tratamento e inclui todos os indivíduos que iniciaram o ensaio clínico, independente se eles concluíram a intervenção e período de seguimento. Considera-se como falha terapêutica todos os casos que foram retirados do estudo por razões de efeitos colaterais e aqueles nos quais não foi possível completar o seguimento de avaliação.
O correto está em:
A pesquisa clínica pode ser conduzida através de diversos tipos de ensaios clínicos. Analise as afirmativas abaixo e marque a alternativa correta.
I. No Estudo aberto comparativo o medicamento estudado será comparado com fármaco análogo ou placebo, porém médico e paciente não terão conhecimento de quem está em qual grupo.
II. No estudo cruzado os sujeitos da pesquisa servem como seus próprios controles.
III. No Estudo paralelo os diferentes tratamentos são ministrados ao mesmo grupo de pacientes, que são comparáveis entre si, durante todo o tempo planejado de estudo.
O correto está em:
Os ensaios clínicos são enquadrados em diferentes fases. Julgue as afirmações subsequentes e marque a alternativa correta.
I. Os estudos da Fase I visam estabelecer o espectro de ação clínica, ou resposta, de uma substância ou combinação de fármacos.
II. Estudos da Fase II são desenhados para se definir a relação entre a dose e a toxicidade de determinado medicamento. Eles servem, ainda, para testar modos diferentes de administração de um mesmo tratamento.
III. Os estudos da Fase III são realizados para se confirmar que os resultados obtidos na fase anterior são aplicáveis em uma grande parte da população doente. Nessa fase, o medicamento já foi aprovado para ser comercializado.
IV. Nos estudos da Fase IV, são exploradas novas indicações de determinado fármaco, além de avaliados os possíveis efeitos colaterais em grandes populações (farmacovigilância).
V. A farmacovigilância também é responsável pela elaboração de projeções sobre o impacto econômico da incorporação de medicamentos no tratamento de determinadas doenças.
O correto está em:
Os estudos Fase IV são realizados após a aprovação e comercialização dos medicamentos. Analise as afirmações abaixo e marque a alternativa correta.
I. Comparar com outros medicamentos visando ampliar a experiência de uso.
II. Identificar e relatar reações adversas.
III. Avaliar o risco e o benefício do uso a longo prazo.
O correto está em:
Os estudos Fase II são algumas vezes divididos em IIA e IIB. Analise as afirmações abaixo.
I. No Fase IIA estuda-se a eficácia com um pequeno número de pacientes e habitualmente uma única dose.
II. No Fase IIB o estudo é conduzido com maior número de pacientes e é planejado para determinar as doses que serão utilizadas no estudo Fase III.
III. No Fase IIA não se estuda a farmacocinética do fármaco.
O correto está em:
Estima-se que em torno de 40% dos medicamentos fracassem nos estudos Fase I. Baseado nessas observações, preconizou-se a realização de estudos Fase 0. Analise as afirmações abaixo.
I. Utiliza-se uma dose única bem abaixo da HED (human equivalente dose/dose equivalente em humano) do fármaco em estudo.
II. Permite a determinação da segurança do fármaco em estudo.
III. Fornece informações iniciais sobre a farmacocinética do fármaco em estudo.
O correto está em:
A pesquisa e o desenvolvimento de novos medicamentos envolvem atividades multiprofissionais que culminam com a pesquisa com seres humanos. Esses estudos estão divididos em Fases I, II, III e IV. Nesse sentido, em que fase ou fases são avaliadas a segurança e a dosagem dos medicamentos?
O correto está em: