Questões de Concurso
Para fub
Foram encontradas 14.965 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
A relação entre pressão e volume é norteada pela lei de
Avogadro.
Julgue o item a seguir, referentes à cinética química, às leis de velocidade e à equação de Arrhenius.
O modelo de Arrhenius considera que a energia de ativação,
a temperatura e a constante universal dos gases perfeitos são
os únicos parâmetros que influenciam a constante cinética de
uma reação.
Julgue o item a seguir, referentes à cinética química, às leis de velocidade e à equação de Arrhenius.
Define-se energia de ativação como a barreira energética que
tem de ser suplantada pelos reagentes para iniciar-se uma
reação, a qual será mais rápida quanto maior for a energia de
ativação.
Julgue o item a seguir, referentes à cinética química, às leis de velocidade e à equação de Arrhenius.
A energia de ativação para a reação de decomposição do
dióxido de nitrogênio pode ser determinada a partir de um
conjunto de experimentos em que se meça a taxa de reação a
diferentes temperaturas.
Julgue o item a seguir, referentes à cinética química, às leis de velocidade e à equação de Arrhenius.
Um processo elementar é aquele descrito por uma equação
que especifica as quantidades de partículas do reagente e do
produto envolvidas em dada etapa reacional.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
Considera-se que o potencial produzido por uma célula
galvânica seja a soma das contribuições do anodo e do
catodo, ainda que o potencial de junção líquida seja
considerável.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
A equação de Gibbs, ΔG = ΔGº + RT lnQ, traduz a
dependência da tensão imposta a células eletroquímicas em
relação às concentrações das espécies envolvidas.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
O potencial arbitrariamente atribuído ao eletrodo-padrão de
hidrogênio, na faixa de temperatura de 20 ℃ até 30 ℃, é
0 V.
Acerca de equilíbrio químico, julgue o item subsequente.
O princípio de Le Châtelier permite prever como a mudança
da pressão afetaria o equilíbrio de uma reação química.
Acerca de equilíbrio químico, julgue o item subsequente.
A equação de Van Del Waals oferece uma descrição
quantitativa da constante de equilíbrio em dada temperatura.
Acerca de equilíbrio químico, julgue o item subsequente.
Considere que, para a reação
2 NOCl (g) ⇌ 2 NO (g) + Cl2 (g), ocorrendo a 796 ℃, a
constante de equilíbrio com base nas concentrações valha
Kc = 3,75 × 10−6 e que a constante universal dos gases
perfeitos valha 0,082 L · atm · K−1 · mol−1. Nesse caso, a
constante de equilíbrio com base nas pressões parciais, Kp, é
inferior a 1 × 10−4.
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Considere um gás ideal com capacidade calorífica constante de ÿ passando por um processo reversível adiabático. Nesse caso, a razão entre as temperaturas inicial e final, T1 e T2, e as pressões inicial e final, P1 e P2, desse sistema pode ser corretamente escrita pela seguinte fórmula.
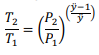
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Para um sistema irreversível, a entropia pode ser escrita,
matematicamente, como a quantidade de calor dividida pela
temperatura.
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Considere que um molde de aço de 40 g, com capacidade
calorífica à pressão constante cp = 0,5 kJ · kg−1
· K−1
,
inicialmente a 450 ºC, tenha sido resfriado em um óleo com
capacidade calorífica à pressão constante
cp = 2,5 kJ · kg−1
· K−1
, inicialmente a 25 ºC. Nessa situação,
a variação de entropia será superior a +16 kJ/K,
considerando-se a ausência de perdas térmicas.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Reações químicas espontâneas têm maior probabilidade de
ocorrência em sistemas isentrópicos.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Em sistemas reais, o balanço de entropia é um fator
importante no cálculo dos trabalhos real e ideal.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Uma reação química com variação de entropia negativa e
variação de entalpia positiva é espontânea.
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Um processo será reversível quando seu sentido puder ser
revertido em qualquer ponto do processo por uma variação
infinitesimal das condições externas.
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Considerando-se a aceleração da gravidade como igual a
9,8 m/s2
, é correto afirmar que a energia potencial de 1 kg de
água, no topo de uma queda de água de 100 m em relação à
sua base, vale 980 J.
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Considere que 2.256,9 kJ de calor tenham sido adicionados a 1 kg de água líquida, vaporizando-a completamente à temperatura constante de 100 ℃ e à pressão constante de 101,33 kPa. Admitindo-se que os volumes específicos da água líquida e do vapor de água sejam, respectivamente, 0,00104 m3 /kg e 1,673 m3 /kg, é correto afirmar que, nas condições apresentadas, as variações de entalpia e de energia valem, respectivamente, menos de 2.090 kJ e mais de 2.250 kJ.