Questões de Concurso
Para seed-pr
Foram encontradas 2.615 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
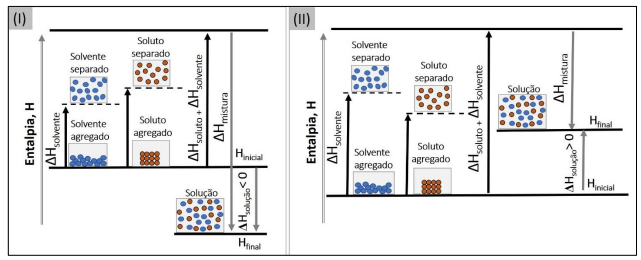
Dados: NaCl ΔHsolução= 3,9 kJ.mol-1 ; MgSO4 ΔHsolução= –91,2 kJ.mol-1 ; NH4NO3 ΔHsolução= 26,4 kJ.mol-1 .
Considerando a imagem, os dados fornecidos e os conceitos relacionados ao tema, assinale a afirmativa correta.
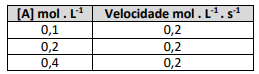
A partir das informações, a Lei de Velocidade para esta reação será de:
( ) A radiação gama consiste em fótons de alta energia e não muda o número atômico nem a massa atômica de um núcleo. ( ) Quanto menor a energia de coesão, mais estável é o núcleo no sentido da decomposição. ( ) Os núcleos 2He4 , 20Ca40 e 43Tc98 exibem estabilidade. ( ) O produto formado quando o rádio-226 sofre decaimento alfa é 86 Rn222 .
A sequência está correta em
I. Existem 2,53 x 1024 átomos de H em 0,350 mol de C6H12O6. II. Em uma molécula de tetracloreto de carbono existem 1,02 x 10-22 g. III. São produzidas 0,3 g de água na oxidação de 1 g de glicose – C6H12O6.
Está correto o que se afirma apenas em
I. Quando o sulfeto de chumbo e o óxido de chumbo são aquecidos juntos, os produtos são chumbo metálico e dióxido de enxofre. Se 14 g de óxido de chumbo reagem, forma-se 9,42 x 10-2 mol de átomos de chumbo. II. O mais importante processo comercial para converter N2 do ar em compostos contendo nitrogênio é baseado na reação de N2 e H2 para formar NH3. São formadas 4 mols de NH3 a partir de 3 mols de N2 e 6 mols de H2. III. Xileno é uma substância composta somente de carbono e hidrogênio. Uma amostra de xileno foi queimada em excesso de oxigênio e este produziu somente como produtos 33,4 g de CO2 e 8,55 g de água. A fórmula empírica do xileno é C4H5.
Está correto o que se afirma em
I. Os elementos em um grupo da tabela têm propriedades similares porque apresentam o mesmo tipo de organização dos elétrons na periferia dos átomos. II. Todos os metais, com exceção do mercúrio, são sólidos à temperatura ambiente. III. Enxofre, fósforo, selênio e telúrio são elementos não-metálicos.
Está correto o que se afirma em
I. Nos éteres, o oxigênio apresenta hibridação sp3 e o ângulo entre os grupos ligados ao oxigênio é de, aproximadamente, 110°. II. A solubilidade dos éteres em água diminui com o aumento do número de átomos de carbono. III. As temperaturas de ebulição dos éteres são mais altas que as dos alcanos de massa molar semelhante e bem mais baixa que as dos álcoois de mesma massa molar.
Está correto o que se afirma em
I. As interações dipolo-dipolo são mais fracas do que as forças entre íons e diminuem rapidamente com a distância, especialmente nas fases líquida e gás, em que as moléculas estão em rotação. II. O aumento do ponto de ebulição dos gases nobres, do hélio ao xenônio, se deve à energia das interações de London que diminui com o número de elétrons. III. As repulsões entre moléculas são o resultado da superposição de orbitais de moléculas vizinhas e do princípio da exclusão de Pauli.
Está correto o que se afirma em
( ) De acordo com a teoria de Bohr, o elétron do átomo de hidrogênio no estado fundamental pode absorver várias quantidades discretas de energia e, assim, elevar-se a um nível de energia mais alto. ( ) A teoria atômica de Dalton explicou as leis da combinação química propondo que a matéria consiste em átomos indestrutíveis com massas que não mudam no decorrer das reações químicas. ( ) Quando elétrons absorvem ou emitem energia ao passarem de uma órbita eletrônica para outra, a energia é dada pela equação: E = mZ2e 4 . h. ( ) Os raios catódicos são um fluxo de elétrons que se movem em linha reta e são dependentes do material dos eletrodos e do gás residual que existe no tubo.
A sequência está correta em
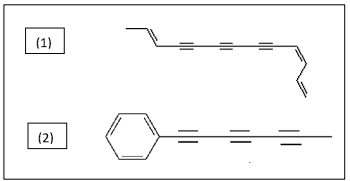
(Barbosa, 2011.)
O nome sistemático dos compostos 1 e 2 são, respectivamente:
I. Uma maneira de reduzir a quantidade de SO2 liberada no meio ambiente é utilizar calcário em forno que, ao reagir com óxido de cálcio, produzirá sulfito de cálcio. II. Uma das etapas finais no tratamento da água é utilizar um agente químico. A ação esterilizante do cloro deve-se provavelmente não a Cl2 propriamente dito, mas ao ácido hipocloroso, que se forma quando o cloro reage com a água. III. Quando a água contendo íons cálcio e íons de bicarbonato for aquecida, parte do dióxido de carbono é expelida. Como resultado, a solução torna-se menos ácida e forma-se carbonato de cálcio insolúvel.
Está correto o que se afirma em
Fe2O3(s) + 3CO(g) → 2 Fe(s) + 3CO2(g)
Com 75 g de Fe2O3 como reagente limitante, qual é o rendimento percentual se o rendimento real de Fe no teste foi 36,7 g?
I. As afinidades eletrônicas dos gases nobres são todas positivas, porque o elétron adicionado ocuparia um novo subnível de energia mais alta.
II. A diminuição na energia de ionização do Berílio ao Boro ocorre porque os elétrons no orbital preenchido 2s são mais eficientes em blindar os elétrons no subnível 2p do que são em se blindarem.
III. Em uma série isoeletrônica, o tamanho dos átomos aumenta com o aumento da carga nuclear à medida que os elétrons são atraídos mais fortemente pelo núcleo.
Está correto o que se afirma em