Questões de Concurso
Para ufal
Foram encontradas 3.463 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Fe3O4(s)+ 4 H2(g)↔ 3 Fe(s)+ 4 H2(g) ΔH = -209,5 kcal.mol -1
e considerando as afirmações seguintes,
I. A adição de um catalisador desloca o equilíbrio para direita.
II. O aumento da pressão desloca o equilíbrio para a esquerda.
III. A diminuição da temperatura desloca o equilíbrio para a direita.
IV. A diminuição da pressão desloca o equilíbrio para a direita.
V. O aumento da temperatura desloca o equilíbrio para a esquerda.
verifica-se que está(ão) correta(s)
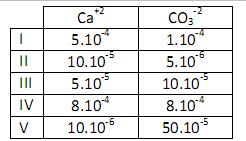
Dessa forma, podemos afirmar que
Hg(l) + ½ O2(g) → HgO(s)ΔH = - 90KJ.mol -1
na formação de 72g de HgO(s), ocorre
Dados: Hg = 200; O = 16
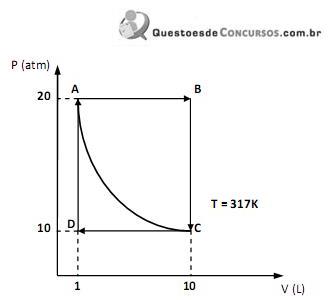
Dado: R = 2 cal.K-1 .mol-1 ; ln 10 = 2,3
I. NH3(aq)+ H2O(l)→ NH4+(aq)+ OH¯(aq)
II. Fe2O3(s)+ 2Al(s) → 2Fe(l) + Al2O3(s)
III. 2K(s) + 2H2O(l) → 2KOH(aq)+ H 2(g)
IV. 2H2S(g)+ 4Ag(s) + O2(g)→ 2Ag2S(s)+ 2H2O(l)
São reações de oxidação-redução:
I. Cloreto de potássio.
II. Carbonato de sódio.
III. Cloreto de amônio.
IV. Acetato de sódio.
V. Fluoreto de lítio.
quais as soluções aquosas dos sais referidos que vão apresentar um pH acima de 7?
Assinale a opção que contém a fórmula química desses sais, respectivamente.
Dados: H = 1; S = 32; O = 16; Na = 23
I. Mistura de mercúrio e ouro, da extração do minério aurífero.
II. Álcool (l) + Acetona (l).
III. Água (l) + Açúcar (s).
IV. Fração gasosa do petróleo (Metano + Etano + Propano + Butano).
constituem sempre sistemas homogêneos, qualquer que seja a proporção:
