Questões de Concurso Para see-al
Foram encontradas 801 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
A transformação isotérmica é definida pela Lei de Boyle, segundo a qual o volume e pressão são inversamente proporcionais, mesmo quando ocorre variação na quantidade de matéria.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Sabendo-se que a densidade dos gases pode ser definida pela sua massa molar e considerando-se que M(C) = 12 g/mol, M (O) = 16 g/mol, M (H) = 1 g/mol, M (Ar) = 40 g/mol e M(N) = 14 g/mol e que a composição do ar em volume seja de 78% de N2, 21% de O2 e 1% de Ar, é correto afirmar que os gases CO2, NH3 e CH4 são mais densos que o ar atmosférico

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Considerando-se que o ar atmosférico que respiramos seja composto por CO2, O2, N2 e H2O, com 20,9% de O2, e que, no nível do mar, a pressão atmosférica seja de 760 mmHg, é correto afirmar que a pressão parcial exercida pelo O2 é de 0,209 atm.
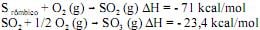
Considerando essas equações químicas, julgue os itens seguintes.
As reações de formação dos óxidos de enxofre são endotérmicas.
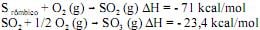
Considerando essas equações químicas, julgue os itens seguintes.
Para um processo que ocorre sob temperatura constante, a energia livre de Gibbs pode ser calculada por ΔG = ΔH - T ΔS.