Questões de Concurso
Para mpu
Foram encontradas 7.738 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Os rotâmetros são formados por duas peças fundamentais: um tubo cônico vertical com o diâmetro maior voltado para cima, pelo qual passa o fluido; e um flutuador de diâmetro ligeiramente inferior ao menor diâmetro do tubo cônico.
As bombas podem ser classificadas em dois grupos: bombas cinéticas ou rotodinâmicas e bombas de deslocamento positivo ou volumétricas.
A perda de carga total é calculada pela diferença entre as perdas de carga localizadas e distribuídas. Na operação de bombeamento em dutos, essa perda refere-se à soma da energia perdida pelo fluido, durante seu deslocamento, devido aos efeitos de atrito do escoamento nos dutos, aos acessórios da tubulação, às entradas e saídas e às mudanças de área.
Para a escolha de uma bomba, deve-se considerar a necessidade de vazão do fluido que se deseja transportar, além de sua natureza e condições. A perda de carga a ser vencida pelo bombeamento não interfere nessa escolha.
A fim de se prevenir a cavitação e permitir a operação satisfatória da bomba, o valor NPSHR referente à altura de sucção positiva líquida requerida das bombas centrífugas deve ser igual ou maior que o valor NPSHA relacionado à altura de sucção positiva líquida disponível.
 , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

Considere que a reação de hidrogenação em apreço seja de ordem um com relação ao
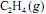 e de ordem um com relação ao
e de ordem um com relação ao 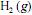 , e que as concentrações iniciais de cada um dos dois reagentes sejam iguais a
, e que as concentrações iniciais de cada um dos dois reagentes sejam iguais a  . Nessas condições, a concentração de
. Nessas condições, a concentração de 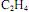 em um instante t da reação é dada por
em um instante t da reação é dada por 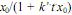 , em que k' é a constante de velocidade na temperatura da reação.
, em que k' é a constante de velocidade na temperatura da reação.  , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

A energia de ativação da reação de hidrogenação catalisada pelo metal B é superior à da reação catalisada pelo metal A.
 , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

Sob determinada temperatura, a reação de hidrogenação do
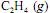 liberará maior quantidade de calor se realizada a volume constante, e não a pressão constante.
liberará maior quantidade de calor se realizada a volume constante, e não a pressão constante.  , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

A constante de equilíbrio para a reação de hidrogenação do
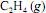 a 100 ºC é maior que a 25 ºC.
a 100 ºC é maior que a 25 ºC. 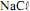 operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de
operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de 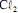 . Considerando que a massa molar do
. Considerando que a massa molar do 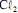 seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.
seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.Na eletrólise da solução aquosa de
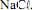 a formação do
a formação do 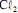 ocorre no ânodo da célula.
ocorre no ânodo da célula.  operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de
operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de  . Considerando que a massa molar do
. Considerando que a massa molar do  seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.
seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.O tempo necessário para a formação de 709 g de
 , a partir da eletrólise da solução aquosa de
, a partir da eletrólise da solução aquosa de  , é superior a 2 h.
, é superior a 2 h. 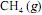 em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.
em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.Na temperatura e pressão correspondentes ao ponto A da figura II, o potencial químico do metano gasoso é superior ao do metano líquido.
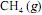 em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.
em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.O CH4 não pode ser liquefeito por simples compressão à temperatura de 150 K, uma vez que o ponto B, na figura II, corresponde à temperatura crítica desse gás.
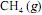 em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.
em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.Infere-se da situação mostrada na figura I que T1 é maior que T2.
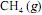 em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.
em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.Na temperatura
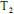 , o
, o 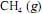 , a 200 bar de pressão, ocupará um volume superior ao estimado pela equação dos gases ideais, o que demonstra que as forças atrativas predominam sobre as forças repulsivas.
, a 200 bar de pressão, ocupará um volume superior ao estimado pela equação dos gases ideais, o que demonstra que as forças atrativas predominam sobre as forças repulsivas. 
Em um reator ideal, de processo contínuo, que opera em estado estacionário, a combustão de
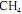 ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com
ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com 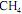 e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado.
e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado. Considerando que, nessa situação, a combustão do
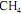 seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de
seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de 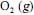 e, o restante, de
e, o restante, de 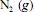 , julgue o item subsequente.
, julgue o item subsequente.A porcentagem, em massa, de
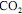 na corrente de saída do reator é superior a 10%.
na corrente de saída do reator é superior a 10%.  , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
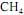 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 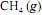 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Se o consumo mensal de energia elétrica da referida empresa for de 1,0 × 1012 J, a combustão do
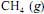 , sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
, sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de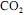 para suprir as necessidades mensais de energia da empresa.
para suprir as necessidades mensais de energia da empresa.  , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
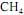 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 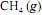 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Considerando-se um comportamento ideal para a mistura sob pressão total p, é correto afirmar que, em uma amostra de gás natural constituída por 95%, em massa, de metano e, o restante, de etano, a pressão parcial do metano será superior a 0,95p.
 , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
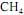 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 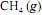 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Considerando-se que as capacidades caloríficas fornecidas na tabela sejam válidas para o intervalo de temperaturas entre 25 ºC e 35 ºC, é correto afirmar que a combustão do
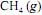 deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC.
deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC.  , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
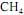 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 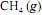 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.A combustão de um mol de
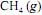 , em condições padrão a 25 ºC, gera uma redução de mais de 1.000 kJ na energia livre de Gibbs do sistema.
, em condições padrão a 25 ºC, gera uma redução de mais de 1.000 kJ na energia livre de Gibbs do sistema. 