Questões de Concurso
Para técnico de operação
Foram encontradas 868 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
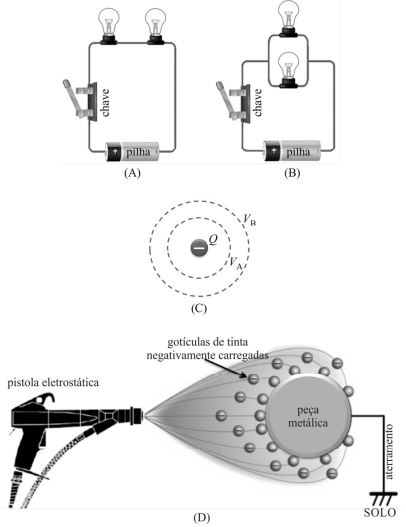
Supondo-se que os elementos que compõem os dois circuitos elétricos esboçados nas figuras (A) e (B) sejam idênticos, é correto afirmar que, quando ligadas as chaves dos dois circuitos, as quatro lâmpadas irradiarão a mesma quantidade de candelas.
A resolução de um paquímetro com unidade fixa de 1 mm e com 20 divisões do nônio é 0,02 mm.
Considere-se que, na figura a seguir, os valores identificados como valores de referência consistem nas massas de referência do conteúdo dos cinco frascos apresentados e que, na linha inferior, os chamados valores na balança correspondem às respectivas massas dos conteúdos dos mesmos frascos medidas em uma balança.

Conclui-se dessas informações que os valores medidos na balança demonstram um erro sistemático no processo de medição.
O Sistema Internacional de Unidades (SI) define sete unidades de base, ou unidades fundamentais, quais sejam: metro, minuto, ampere, grau Celsius, quilograma, candela e mol.
A utilização de ponteiros e de escalas graduadas conduz a erros de visualização, sendo um deles a paralaxe, a qual consiste em um aparente deslocamento do objeto observado, devido a uma mudança no posicionamento do observador.
Acerca da natureza elétrica da matéria, julgue o próximo item.
Conforme o modelo atômico de Dalton, também conhecido
como modelo pudim de passas, o átomo é tal qual uma esfera
de material gelatinoso com carga positiva sobre a qual os
elétrons ficam suspensos.
Um aumento de pressão no sistema onde ocorre a reação II favorece a decomposição do gás AB.
Representando-se por Kc e Kp as constantes de equilíbrio em termos de concentração e pressão, respectivamente, e considerando-se a constante universal dos gases ideais (R) igual a 0,082 atm∙L∙mol−1∙K−1, é correto afirmar que, para a reação I, com Kc = 30 a 573 K, tem-se Kc < Kp .
Considere-se que, processando-se a reação I em um recipiente fechado de 2 L na temperatura T1, o equilíbrio tenha sido atingido com 1 × 10−2 mol de A2, 2 × 10−2 mol de B2 e 4 × 10−2 mol de AB. Assim, caso a temperatura seja alterada para T2, na qual a constante de equilíbrio seja igual a 40, é correto afirmar que, a partir da condição de equilíbrio anterior, a reação favorecida será a inversa, no sentido da formação dos reagentes A2 e B2.
A relação entre as duas constantes de equilíbrio é K2= K1−2.
Na reação apresentada no texto, o ácido H2S é o agente oxidante.
Os números de oxidação do ferro nas espécies Fe e FeS são, respectivamente, 0 e +2.
Considere-se que, para a reação FeS (s) ⇌ Fe2+ (aq) + S2− (aq), a 25 °C, a constante do produto da solubilidade (Kps) seja igual a 2,56 × 10−18. Nesse caso, quando o equilíbrio for alcançado, a solubilidade do FeS em água será inferior a 2 × 10−7 g/L, desconsiderando-se qualquer hidrólise posterior dos íons.
Conforme a definição de Brønsted-Lowry, um ácido, tal como o H2S, é uma espécie que libera íons H+ em solução aquosa.
Se uma peça de aço carbono que contém 5 g de ferro for completamente oxidada pelo H2S, serão formados mais de 8 g de mackinawita.
A partir das informações precedentes, e considerando MH2O= 18 g/mol, julgue o item que se segue.
Para a oxidação de 1 mol de asfalteno, é necessária uma
quantidade de matéria de KMnO4 superior a 11 mol.
A partir das informações precedentes, e considerando MH2O= 18 g/mol, julgue o item que se segue.
Caso um técnico em operações tenha de preparar 10 L de
uma solução de 2,5 mol/L de KMnO4 para oxidar certa
quantidade de asfalteno que esteja entupindo uma tubulação
de extração de petróleo, ele deverá pesar uma massa superior
a 4 kg desse sal.
A partir das informações precedentes, e considerando MH2O= 18 g/mol, julgue o item que se segue.
Em uma solução de 20% de KMnO4 em água, a fração molar
do KMnO4 é inferior a 0,10.
A partir das informações precedentes, e considerando MH2O= 18 g/mol, julgue o item que se segue.
O efeito Tyndall é o espalhamento ou a dispersão da luz
provocada por partículas coloidais, propriedade esta que
permite diferenciar uma solução verdadeira de uma solução
coloidal.
A partir das informações precedentes, e considerando MH2O= 18 g/mol, julgue o item que se segue.
A diferença entre uma suspensão sólida e um gel encontra-se
no fato de que a primeira é uma suspensão de um sólido em
outro sólido, ao passo que o segundo é uma suspensão de um
líquido em um sólido.