Questões de Concurso
Para químico
Foram encontradas 3.609 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A constituição da matéria está presente no vocabulário científico desde a Grécia antiga, mas sem comprovação científica, apenas filosófica. Como conhecimento científico os modelos atômicos foram formulados a partir de 1808 e à medida que novos e melhores métodos de investigação foram sendo desenvolvidos, evoluídos. A seguir, são apresentadas as representações gráficas de alguns modelos atômicos:
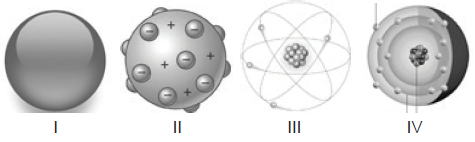
Julgue os itens a seguir:
( ) Dalton, figura I, tomou como base para o desenvolvimento de seu modelo atômico análises de conservação e proporcionalidade da massa em uma reação, originárias de Lavoisier e Proust.
( ) O modelo atômico de Thomson , figura II, apresenta a ideia de descontinuidade pela primeira vez e apresenta a primeira subpartícula atômica encontrada: o elétron.
( ) A figura III representa o modelo atômico de Rutherford, destacando o surgimento da ideia de núcleo positivo, sem os nêutrons que só seriam descobertos por Sommerfeld em 1932.
( ) A figura IV representa o átomo de Chadwick, organizando os níveis de energia eletrônicos pela primeira vez.
Assinale a alternativa que contém a análise correta em verdadeiro (V) e falso (F) para os itens apresentados.
Uma das etapas de enriquecimento do urânio consiste na separação do hexafluoreto de urânio, contendo U-235 do U-238, analise o esquema representado a seguir:
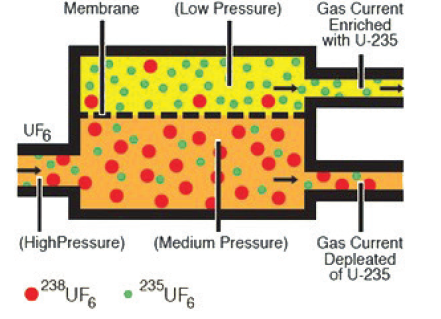
I. Ocorre redução da pressão do sistema naturalmente, pois na linha de entrada da mistura de gases, ocorre uma expansão na chegada a câmara de difusão em membrana.
II. A introdução de um sistema de vácuo na linha do U -235 enriquecido favorece a maior velocidade da separação dos componentes do sistema.
III. A difusão do composto contendo U-238 pela membrana é mais intensa, por isso é necessário reduzir a pressão do sistema garantindo assim a maior passagem pela membrana do composto contendo U – 235.
São verdadeiras as afirmações contidas na alternativa:
Um tubo inicialmente cheio de água (B) foi conectado a outro tubo (A), ao qual foi adicionada solução de ácido clorídrico e raspas de zinco com alto grau de pureza. O sistema foi fechado e após algum tempo, apresentava-se como indicado na figura.
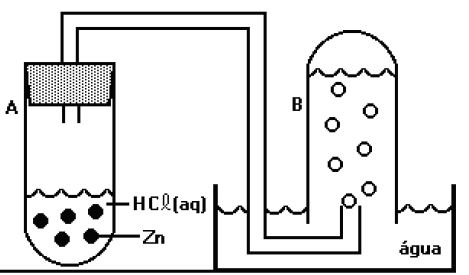
Analise as propostas a seguir:
I. Parte significativa do gás hidrogênio ficará retida na água formando uma solução de caráter ácido.
II. A pressão de vapor da água, na temperatura da realização do experimento, é importante para o cálculo sobre o volume de hidrogênio, caso não se leve em consideração a pressão de vapor da água o valor de gás hidrogênio obtido será maior que o verdadeiro.
III. Quando o nível da água no interior do tubo B se igualar com o nível da água do restante da cuba, pode-se afirmar que a soma da pressão do hidrogênio com a pressão de vapor da água, na temperatura de realização do experimento, será praticamente igual à pressão atmosférica local. Assinale a alternativa que contém as propostas verdadeiras.
Assinale a alternativa que contém as propostas verdadeiras:
Um cilindro contém uma mistura de 88 g de CO2(g) com uma quantidade desconhecida de gás argônio foi mantido em determinadas condições de pressão e temperatura.
Depois de vários testes, descobriu-se que com a adição de 220g de CO2(g) à mistura, mantendo-se temperatura e pressão constantes, o volume dobra.
Assinale a alternativa que apresenta a quantidade de argônio existente na mistura.
Dados: Massa atômica: Ar=40u; C=12u; O=16u
As características químicas da água ocorrem em função da presença de substâncias dissolvidas, geralmente mensuráveis apenas por meios analíticos.
Relacione a COLUNA II com a COLUNA I associando os indicadores químicos das águas às suas propriedades.
COLUNA I
1. Dureza
2. Alcalinidade
3. Corrosividade
4. Salinidade
COLUNA II
( ) Indicador caracterizado pela presença de ácidos minerais ou soluções de oxigênio que atuam sobre os metais.
( ) Característica conferida à água pela presença de sais de metais alcalino-terrosos e alguns outros metais em menor quantidade.
( ) Presença na água de substâncias como bicarbonatos, cloretos e sulfatos, conferindo a ela um sabor característico.
( ) Característica decorrente da presença de bicarbonatos, carbonatos e hidróxidos, quase sempre de metais alcalinos ou alcalino-terrosos.
Assinale a sequência correta.
Considere que um estudante misturou 20 mL de uma solução aquosa de HCl 1,0 mol/L com 20 mL de uma solução aquosa de NaOH 1,0 mol/L em um calorímetro. A temperatura da mistura reacional aumentou de 20 ºC para 28 ºC.
Partindo do princípio que a perda de calor da mistura reacional para o ambiente é desprezível e que o volume total da mistura é 40 mL, é correto afirmar que a variação da entalpia da reação é mais próxima de
Dados:
Calor específico (c) do meio reacional é igual a 4,18 J/g K.
Densidade (d) da mistura é igual a 1,0 g/mL.
O termo cromatografia é difícil de ser definido rigorosamente porque o nome tem sido aplicado a diversos sistemas e técnicas. Todos esses métodos, contudo, apresentam em comum o uso de uma fase estacionária e de uma fase móvel. A cromatografia gasosa é uma das técnicas mais empregadas em análises qualitativas e quantitativas. Sobre a cromatografia gasosa, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A cromatografia gás–líquido é baseada na partição do analito entre a fase móvel gasosa e uma fase líquida imobilizada na superfície de um material sólido inerte de recheio ou nas paredes de um tubo capilar.
( ) A fase móvel em cromatografia gasosa é denominada gás de arraste e deve ser quimicamente reativa com o analito de interesse.
( ) O sistema de configuração de colunas é composto por seringas calibradas empregadas para configurar o fluxo de gás de arraste e substâncias imóveis.
( ) Nas separações cromatográficas gasosas, dezenas de detectores podem ser empregados, mas o detector de ionização em chama (DIC) é o mais empregado em aplicações da cromatografia gasosa em geral.
Assinale a sequência correta.
A lei de absorção, também conhecida como Lei de Beer, diz quantitativamente como a grandeza da atenuação depende da concentração das moléculas absorventes e da extensão do caminho sobre o qual ocorre a absorção. A transmitância T da solução é a fração da radiação incidente transmitida pela solução.
Considerando que um feixe de radiação, ao passar por uma solução absorvente, registrou uma absorbância X, é correto afirmar que a transmitância será igual a
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
Na área de estudo da potenciometria, sabe-se que o eletrodo indicador é um dispositivo que, imerso na solução contendo o analito, desenvolve um potencial, que depende da atividade do analito. A maioria dos eletrodos indicadores empregados na potenciometria é seletiva em sua resposta.
Um eletrodo que é classificado como eletrodo indicador é o
Analise a situação a seguir.
Em um preparo de 100 mL de uma solução de ácido clorídrico (HCl) 0,1 mol/L, um técnico retirou da solução estoque 1 mL e completou com água até a linha de aferição.
Considerando que a densidade da solução estoque era 1,1 g/mL, qual a porcentagem aproximada em massa do ácido que estava contida no estoque?
Uma série natural de decaimento radioativo começa com uma espécie radioativa que, ao emitir radiações alfa, beta e / ou gama, forma uma espécie mais estável.
Considere que um mol de um elemento radiativo emitiu sete mols de partículas alfa e quatro mols de partículas beta produzindo um mol de um elemento mais estável.
Nesse contexto, qual processo reacional nuclear pode representar esse decaimento radioativo?
A formação de complexos é usada de muitas maneiras em Química Analítica . A análise química nessa área pode ser utilizada, por exemplo, para medir a quantidade de um analito, para controlar a quantidade efetiva deste que está disponível para outras reações ou como ferramenta para separação de substâncias químicas.
Considerando esse contexto, avalie as seguintes afirmativas e a relação proposta entre elas.
I. A formação de complexos é uma reação na qual ocorre uma ligação reversível entre duas ou mais espécies químicas distintas, como por exemplo, a amônia e Cu2+,
POR QUE
II. nesse caso o NH3 fornece um par de elétrons para os orbitais externos de um íon Cu2+, formando um complexo entre a amônia e o íon metálico, característico de uma reação ácido-base de Lewis.
A respeito dessas afirmativas e da relação proposta entre elas, assinale a alternativa correta.
Em análises químicas, os erros sistemáticos têm um valor definido e uma causa justificável, sendo da mesma ordem de grandeza para réplicas de medidas realizadas de maneira semelhante. Existem três tipos de erros sistemáticos: instrumentais, no método e do operador.
Entre os exemplos a seguir, aquele que é considerado um erro instrumental é:
As propriedades das substâncias aumentam sua magnitude de acordo com os tipos de interações entre moléculas predominantes.
Nesse sentido, é correto afirmar que as forças intermoleculares são fortes quando se têm menores
Os métodos potenciométricos de análises se baseiam na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Há cerca de um século, as técnicas potenciométricas têm sido utilizadas para localizar o ponto final em titulações.
Considere que em uma titulação potenciométrica de 10 mL de ácido clorídrico (HCl), a partir de um padrão de NaOH 0,10 mol/L, os resultados experimentais foram estimados utilizando o método da primeira derivada, conforme descrito no gráfico a seguir.
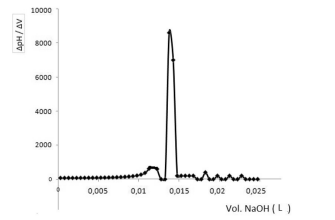
Nesse contexto, a concentração de ácido clorídrico em
mol/L titulado por hidróxido de sódio é igual a
Considerada como técnica analítica bem-sucedida, a espectrometria de absorção atômica é uma das mais utilizadas na determinação de elementos em baixas concentrações, que estão presentes em uma variedade de amostras, líquidas, sólidas, em suspensão ou até mesmo gasosas.
Sobre a técnica de espectrometria de absorção atômica, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A técnica de absorção atômica pode ser aplicada para quantificar vários elementos ao mesmo tempo.
( ) Instrumentos de absorção atômica utilizam um plasma de alta temperatura para atomização e excitação da amostra.
( ) A determinação de espécies atômicas somente é feita em meio gasoso, no qual os átomos individuais ou íons elementares se encontram bem espaçados uns dos outros.
( ) As análises quantitativas pela técnica de absorção atômica são baseadas em calibração com padrões externos e não devem ser fundamentadas na medida de um único padrão, presumindo que a Lei de Beer esteja sendo obedecida.
Assinale a sequência correta.
A Aspirina, como é conhecida o ácido acetilsalicílico (C9H8O4), é um fármaco que apresenta propriedades antitérmicas, anti-inflamatórias e analgésicas. Esse fármaco pode ser sintetizado pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3), catalisada por um ácido.
A equação a seguir representa o processo de síntese da aspirina.
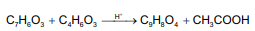
Considere, hipoteticamente, que 3 g de ácido salicílico foram misturados com 6 mL de uma solução de anidrido acético cuja densidade e grau de pureza são 1,2 g/mL e 80% m/m, respectivamente.
Se o rendimento da reação química é 100%, qual a
massa aproximada de aspirina produzida em gramas?
