Questões de Concurso
Para químico
Foram encontradas 3.476 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere os seguintes aminoácidos:
(Números atômicos: H = 1; C = 6; N = 7; O = 8; S = 16).
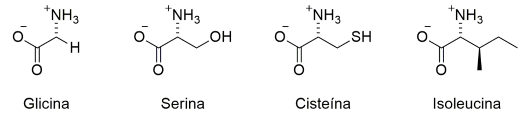
( ) A glicina é aquiral. ( ) A configuração absoluta da serina é R. ( ) A configuração absoluta da cisteína é R. ( ) A isoleucina tem um estereoisômero meso.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
( ) [Co(en)3]3+ apresenta isomerismo ótico. ( ) trans-[Co(en)2Cl2]+ apresenta isomerismo ótico. ( ) [Co(NH3)4Cl2]+ apresenta isomerismo geométrico. ( ) [Co(NH3)5NO2]2+ apresenta isomerismo de ligação.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
A + 3B → 2C + D
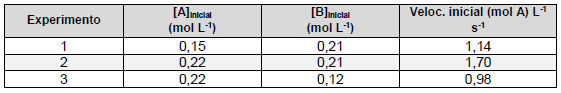
A partir dessas informações, considere as seguintes afirmativas:
1. A reação é de primeira ordem em relação ao reagente A, e também de primeira ordem em relação ao reagente B. 2. A lei de velocidade da reação, baseada na estequiometria da reação, é velocidade = k [A][B]3 , e a ordem global da reação é 4. 3. A lei de velocidade da reação, baseada nos dados experimentais, é velocidade = k [A][B], e a ordem global da reação é 2. 4. O valor de k para o experimento 2 é 36,79 L mol-1 s -1 .
Assinale a alternativa correta.
( ) Se ΔG = 0, a reação não ocorre. ( ) Uma reação espontânea ocorre em qualquer sentido (direto e indireto). ( ) Se ΔG < 0, a reação é espontânea no sentido direto (reagentes→ produtos). ( ) Se ΔG > 0, a reação é espontânea no sentido indireto (produtos→reagentes).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Considere a reação ácido-base entre amônia e água mostrada a seguir:
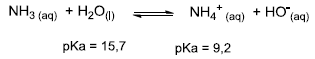
( ) A constante de basicidade da reação será Kb = [NH4+ ][HO- ]/[NH3]. ( ) A adição de NH4Cl deslocará o equilíbrio no sentido dos produtos. ( ) A água é um ácido mais fraco do que o íon amônio (NH4+ ), e o equilíbrio está deslocado no sentido dos reagentes. ( ) A amônia (NH3) é uma base mais forte do que o íon hidróxido, e o equilíbrio da reação está deslocado no sentido dos reagentes.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.

Considerando a dissociação de um ácido genérico (HA) em água, conforme a equação mostrada acima, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) Se HA = HCl, ele estará completamente dissociado e a [H3O+ ] = [HCl]inicial. ( ) HA é o ácido conjugado da H2O enquanto H3O+ é o ácido conjugado de A- . ( ) HA é um ácido de Bronsted-Lowry e H2O é uma base de Bronsted-Lowry. ( ) Se HA = ácido acético, ele estará completamente dissociado e a [H3O+ ] = [ácido acético]inicial.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
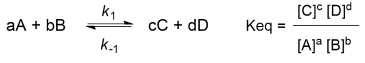
Assumindo que as equações acima são modelos que podem ser aplicados a qualquer reação química, é correto afirmar que, no equilíbrio:
1. as concentrações de A, B, C e D são iguais. 2. as concentrações de A, B, C e D não se alteram com o tempo. 3. a reação para de acontecer, logo, a formação de produtos é interrompida. 4. a constante de velocidade da reação direta (k1) é igual à da reação inversa (k-1).
Assinale a alternativa correta.
C6H12O6(aq) → C2H6O(aq) + CO2(g)
(Massas molares (g mol-1 ): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
Com relação a decaimento, considere as seguintes equações:
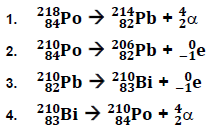
São equações de decaimento:
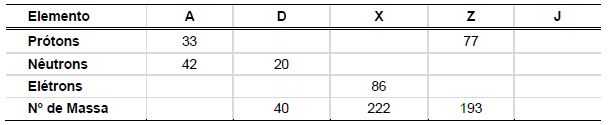
Supondo que os elementos A, D, X, Z e J possam ocorrer na forma de isótopos, e com base nas informações contidas na tabela, é correto afirmar que:
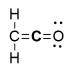
A molécula orgânica ceteno (C2H2O) tem a seguinte estrutura de Lewis: