Questões de Concurso
Para químico
Foram encontradas 3.476 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!

A reação do brometo de alquila com um íon alcóxido pode levar à formação de um alceno ou de um éter, conforme representado na figura acima.
Acerca dessas reações, julgue os itens.

A reação do brometo de alquila com um íon alcóxido pode levar à formação de um alceno ou de um éter, conforme representado na figura acima.
Acerca dessas reações, julgue os itens.
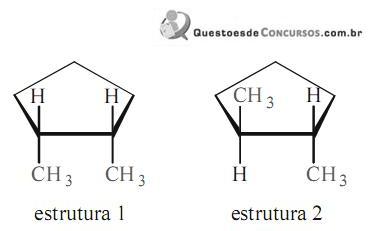
Acerca das estruturas apresentadas acima, julgue o itens.
As estruturas 1 e 2 representam diferentes conformações de um mesmo composto.

O tempo morto, ou seja, o tempo médio necessário para que uma molécula da fase móvel passe através da coluna, foi de 2 min. A calibração foi realizada analisando-se uma mistura-padrão de A e B e utilizando-se o método da normalização da área, cujos dados são apresentados na tabela a seguir.

Considerando as informações fornecidas, julgue os itens subsequentes.

O tempo morto, ou seja, o tempo médio necessário para que uma molécula da fase móvel passe através da coluna, foi de 2 min. A calibração foi realizada analisando-se uma mistura-padrão de A e B e utilizando-se o método da normalização da área, cujos dados são apresentados na tabela a seguir.

Considerando as informações fornecidas, julgue os itens subsequentes.

A determinação de cromo em uma amostra aquosa foi realizada por espectrometria de absorção atômica. No procedimento, 10,0 mL da solução-problema foram misturados com volumes diferentes de uma solução-padrão de cromo a 12 mg/L (ppm) e, a seguir, o volume foi completado até 50 mL com água. A figura acima apresenta o gráfico de variação da absorvância versus volume da solução-padrão adicionado.
Acerca da situação descrita acima, julgue os itens a seguir.

A determinação de cromo em uma amostra aquosa foi realizada por espectrometria de absorção atômica. No procedimento, 10,0 mL da solução-problema foram misturados com volumes diferentes de uma solução-padrão de cromo a 12 mg/L (ppm) e, a seguir, o volume foi completado até 50 mL com água. A figura acima apresenta o gráfico de variação da absorvância versus volume da solução-padrão adicionado.
Acerca da situação descrita acima, julgue os itens a seguir.
Com relação a fundamentos, equipamentos e ferramentas envolvidos na aplicação desses métodos, julgue os itens seguintes.
Com relação a fundamentos, equipamentos e ferramentas envolvidos na aplicação desses métodos, julgue os itens seguintes.
Com relação a fundamentos, equipamentos e ferramentas envolvidos na aplicação desses métodos, julgue os itens seguintes.
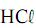 à solução de NaOH, o pH da solução resultante será maior que 12.
à solução de NaOH, o pH da solução resultante será maior que 12.A energia de ativação da reação catalisada é maior que 50 kJ/mol.

Com referência à célula galvânica descrita, considerando que as soluções envolvidas apresentam comportamentos ideais e que log 5 = 0,7 e log 2 = 0,3, julgue os itens seguintes.

Com referência à célula galvânica descrita, considerando que as soluções envolvidas apresentam comportamentos ideais e que log 5 = 0,7 e log 2 = 0,3, julgue os itens seguintes.

A figura acima representa uma transformação cíclica a que um gás ideal foi submetido. Com relação a essa transformação, julgue os próximos itens.

A figura acima representa uma transformação cíclica a que um gás ideal foi submetido. Com relação a essa transformação, julgue os próximos itens.
 não varia no intervalo de temperaturas entre 373 K e 400 K.
não varia no intervalo de temperaturas entre 373 K e 400 K.Com referência à situação hipotética descrita acima, julgue os itens.
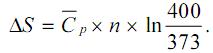
 não varia no intervalo de temperaturas entre 373 K e 400 K.
não varia no intervalo de temperaturas entre 373 K e 400 K.Com referência à situação hipotética descrita acima, julgue os itens.
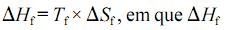 representa a variação de entalpia para a fusão do gelo;
representa a variação de entalpia para a fusão do gelo; 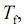 a temperatura de fusão do gelo; e
a temperatura de fusão do gelo; e 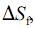 , a variação de entropia para a fusão do gelo.
, a variação de entropia para a fusão do gelo. não varia no intervalo de temperaturas entre 373 K e 400 K.
não varia no intervalo de temperaturas entre 373 K e 400 K.Com referência à situação hipotética descrita acima, julgue os itens.