Questões de Concurso
Para químico
Foram encontradas 3.476 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!

Com base nessas informações, julgue os itens que se seguem.
Caso, na reação acima, a coloração amarela torne-se mais intensa ao se aumentar a temperatura do sistema, é correto concluir que a reação será endotérmica no sentido da formação de
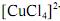 .
. 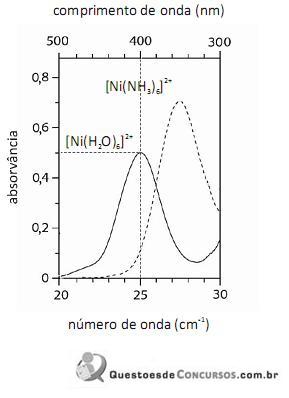

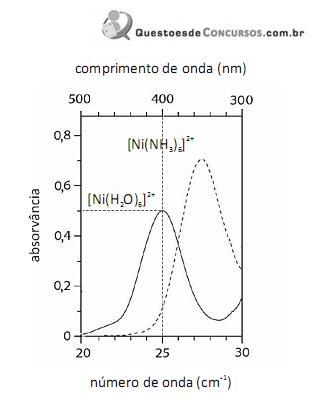
De acordo com a lei de Beer, infere-se do espectro do complexo
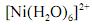 que, para uma radiação com comprimento de onda igual a 400 nm, a absortividade molar é maior que
que, para uma radiação com comprimento de onda igual a 400 nm, a absortividade molar é maior que 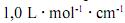 .
. 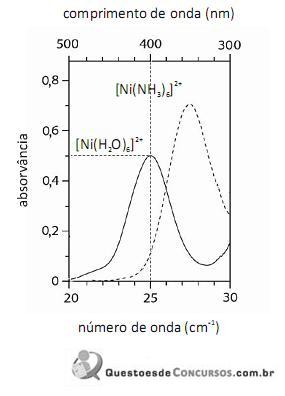

O fato de os espectros acima apresentarem largas bandas de absorção, em vez de linhas ou picos estreitos, demonstra que o equipamento utilizado não possuía monocromador.
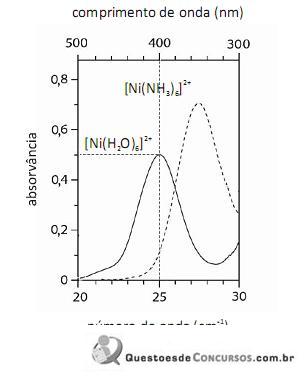

A análise espectroscópica do
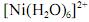 mostra que a razão entre o número de fótons com comprimento de onda igual a 400 nm que atinge o transdutor e o número desses fótons que atinge a amostra é maior do que 0,40.
mostra que a razão entre o número de fótons com comprimento de onda igual a 400 nm que atinge o transdutor e o número desses fótons que atinge a amostra é maior do que 0,40. 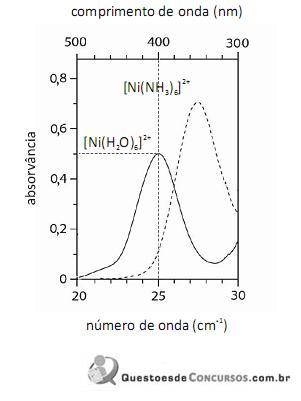

Em face dos espectros acima apresentados, é correto concluir que o módulo do valor da energia de estabilização do campo cristalino (EECC) para o complexo
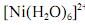 é superior a 4,0×10-19 J.
é superior a 4,0×10-19 J. 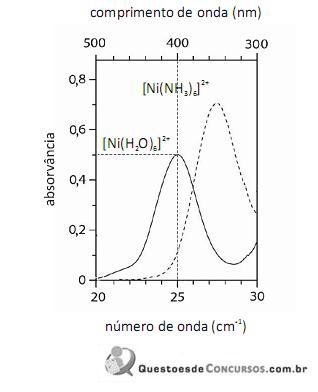

Considerando-se a teoria do campo cristalino e os espectros acima apresentados, é correto afirmar que a água consiste em um ligante de campo mais fraco que a amônia.



Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
De acordo com a nomenclatura sistemática, o composto
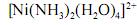 denomina-se diamintetraaquoniquelato.
denomina-se diamintetraaquoniquelato. 
Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
A constante de equilíbrio K pode ser calculada por meio da expressão K =
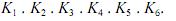

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
Nos complexos de coordenação, os ligantes atuam como ácidos de Lewis.

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
Considerando-se que o complexo
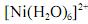 possui comportamento paramagnético, é correto afirmar que sua geometria é tetragonal distorcida, devido à ocorrência do efeito Jahn-Teller.
possui comportamento paramagnético, é correto afirmar que sua geometria é tetragonal distorcida, devido à ocorrência do efeito Jahn-Teller. 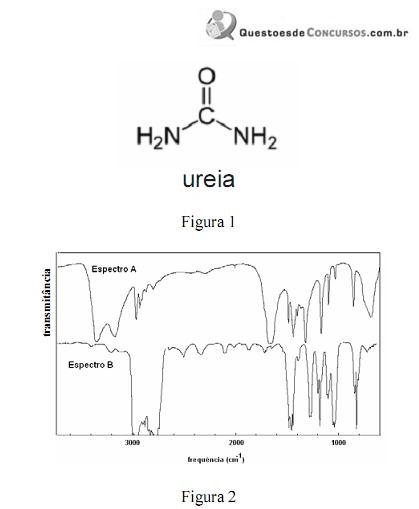
A amônia serve como substrato para a síntese de um grande número de substâncias, como aminas e amidas. Merece destaque a ureia, que é largamente empregada como fertilizante e cuja estrutura é apresentada na figura 1. Na figura 2, são apresentados os espectros de infravermelho de duas outras substâncias que podem ser sintetizadas a partir da amônia: a propanamida e a trietilamina, sendo que os espectros não estão apresentados, necessariamente, nessa ordem. Com relação aos derivados da amônia citados e aos espectros apresentados, julgue os itens que se seguem.
A ureia apresenta basicidade mais elevada que a amônia.
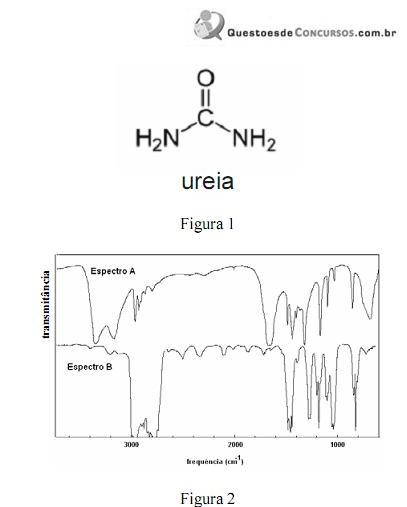
A amônia serve como substrato para a síntese de um grande número de substâncias, como aminas e amidas. Merece destaque a ureia, que é largamente empregada como fertilizante e cuja estrutura é apresentada na figura 1. Na figura 2, são apresentados os espectros de infravermelho de duas outras substâncias que podem ser sintetizadas a partir da amônia: a propanamida e a trietilamina, sendo que os espectros não estão apresentados, necessariamente, nessa ordem. Com relação aos derivados da amônia citados e aos espectros apresentados, julgue os itens que se seguem.
Considere as informações a seguir.


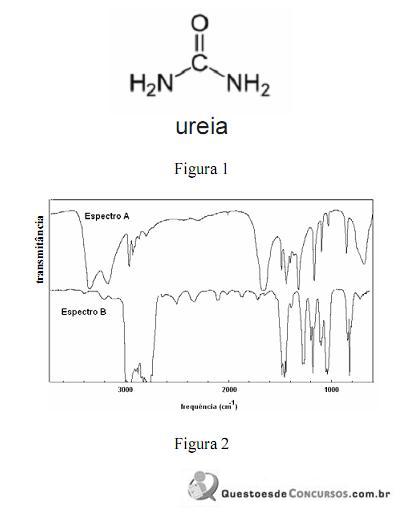
A amônia serve como substrato para a síntese de um grande número de substâncias, como aminas e amidas. Merece destaque a ureia, que é largamente empregada como fertilizante e cuja estrutura é apresentada na figura 1. Na figura 2, são apresentados os espectros de infravermelho de duas outras substâncias que podem ser sintetizadas a partir da amônia: a propanamida e a trietilamina, sendo que os espectros não estão apresentados, necessariamente, nessa ordem. Com relação aos derivados da amônia citados e aos espectros apresentados, julgue os itens que se seguem.
Na figura 2, os espectros A e B correspondem, respectivamente, aos espectros da propanamida e da trietilamina.
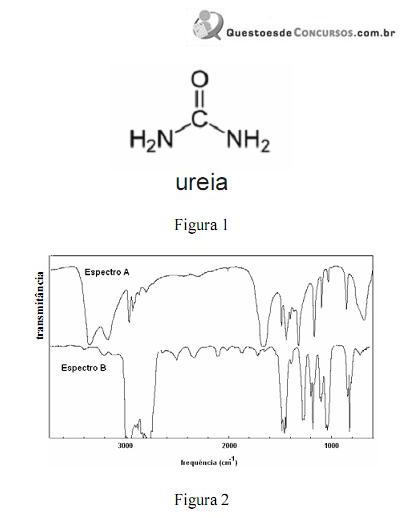
A amônia serve como substrato para a síntese de um grande número de substâncias, como aminas e amidas. Merece destaque a ureia, que é largamente empregada como fertilizante e cuja estrutura é apresentada na figura 1. Na figura 2, são apresentados os espectros de infravermelho de duas outras substâncias que podem ser sintetizadas a partir da amônia: a propanamida e a trietilamina, sendo que os espectros não estão apresentados, necessariamente, nessa ordem. Com relação aos derivados da amônia citados e aos espectros apresentados, julgue os itens que se seguem.
A etilamina apresenta ponto de ebulição menor que o etanol.
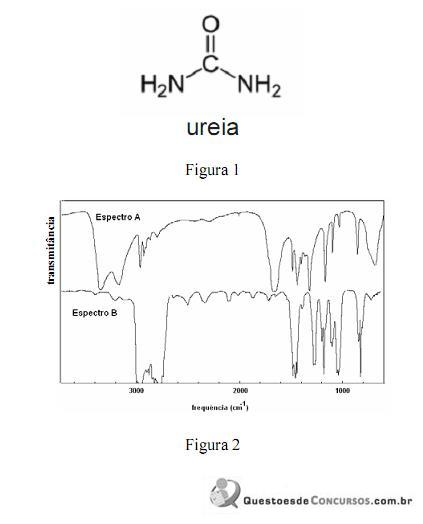
A amônia serve como substrato para a síntese de um grande número de substâncias, como aminas e amidas. Merece destaque a ureia, que é largamente empregada como fertilizante e cuja estrutura é apresentada na figura 1. Na figura 2, são apresentados os espectros de infravermelho de duas outras substâncias que podem ser sintetizadas a partir da amônia: a propanamida e a trietilamina, sendo que os espectros não estão apresentados, necessariamente, nessa ordem. Com relação aos derivados da amônia citados e aos espectros apresentados, julgue os itens que se seguem.
A reação da amônia com a propanona resulta na formação da etanamida.

Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
Para a reação apresentada,
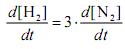 .
. 
Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
A reação acima é elementar, ou seja, processa-se em uma única etapa.

Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
A construção de um gráfico de ln
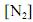 , em função de t, resulta em uma linha reta.
, em função de t, resulta em uma linha reta. 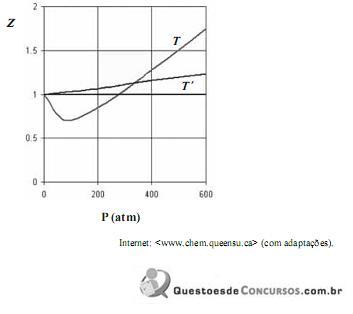
Considerando que, sob pressões elevadas, os gases deixam de apresentar comportamento ideal, e que a figura acima apresenta as curvas do coeficiente de compressibilidade (Z) para o
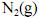 em duas temperaturas distintas (T e T’), julgue os itens subsequentes.
em duas temperaturas distintas (T e T’), julgue os itens subsequentes.À temperatura T’ e à pressão de 200 atm, o
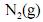 apresenta volume molar maior que o previsto pela lei dos gases ideais.
apresenta volume molar maior que o previsto pela lei dos gases ideais.