Questões de Concurso
Para químico
Foram encontradas 3.615 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Sobre a análise de água e esgoto, analise as assertivas a seguir:
I. O objetivo do exame microbiológico da água é fornecer subsídio a respeito da sua potabilidade, isto é, ausência de risco de ingestão de micro-organismos causadores de doenças, geralmente provenientes da contaminação pelas fezes humanas e outros animais.
II. Equipamentos como autoclave, balança analítica e estufa são comuns em um laboratório de microbiologia.
III. Na água contaminada por esgoto sanitário, não estão presentes micro-organismos que podem ser prejudiciais à saúde humana.
IV. Como indicadores de contaminação fecal, são eleitas como bactérias de referência as do grupo coliforme. O principal representante desse grupo de bactérias chama-se Escherichia coli.
Quais estão corretas?
Qual das seguintes medidas é mais eficaz para prevenir acidentes no uso de máquinas e equipamentos em um ambiente de trabalho?
A atmosfera funciona como um cobertor protetor que sustenta a vida na Terra. Considerando os poluentes atmosféricos, assinale a alternativa que apresenta a principal atividade humana responsável pela emissão de dióxido de carbono (CO₂) na atmosfera.
Qual das seguintes alternativas descreve corretamente os princípios metodológicos aplicados nos testes de Demanda Bioquímica de Oxigênio (DBO) e Demanda Química de Oxigênio (DQO) para análises de água?
Analise a linguagem e o formato do exemplo abaixo e assinale a alternativa que corresponde ao nome do documento.
O Diretor do Departamento de Recursos Humanos, no uso de suas atribuições legais, resolve:
Art. 1º Instituir o Programa de Capacitação Continuada para os servidores do órgão.
Art. 2º Este(a) [nome do documento] entra em vigor na data de sua publicação.
[Nome/Assinatura]
Diretor do Departamento de Recursos Humanos
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
Leia o trecho a seguir, retirado do texto, e assinale a alternativa que apresenta uma análise correta sobre a estrutura morfossintática do período e o emprego das classes das palavras.
“O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro disse ter uma relação especial com a vizinhança: ‘Ajudei a construir metade dessa vila’, contou com a voz embargada”.
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
Qual das alternativas abaixo apresenta uma frase com a correta colocação do pronome átono?
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
Leia o trecho a seguir, retirado do texto, e assinale a alternativa que apresenta a melhor reorganização da estrutura de orações e períodos.
“A casa onde criou a família levou décadas para ficar como ela queria. ‘Nós tínhamos uma casinha velha, de madeira, que ganhamos da Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte da casa, em alvenaria’, contou. ‘A gente foi botando telhado. O piso, fomos pagando em prestações. Por último ▲ foi feita uma área numa parte para fora, com churrasqueira’, e assim Odila ia descrevendo a casa”.
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
Na frase “O bairro já havia sido severamente atingido pela enchente de setembro do ano passado”, retirada do texto, se o termo sublinhado fosse flexionado em sua forma no plural, quantas outras alterações seriam necessárias para manter a correta concordância verbo-nominal?
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
A expressão “uns troquinhos” (l. 08) poderia ser substituída, sem alteração de sentido, pela expressão:
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
Leia o trecho a seguir, retirado do texto, e assinale a alternativa que apresenta a reescrita correta, mantendo o sentido original e aplicando as normas gramaticais.
“Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo, advinda da morte do marido, há 21 anos”.
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
Os símbolos das linhas 05, 10 e 21 podem ser substituídos, respectivamente, por quais sinais de pontuação?
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
Em relação ao acento indicativo de crase, assinale a alternativa que preenche, correta e respectivamente, as lacunas tracejadas das linhas 05, 13 e 28.
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
Analise as assertivas a seguir, de acordo com o texto:
I. O pronome “eles” (l. 24) retoma a palavra “caminhão” (l. 23).
II. A expressão “A gente” (l. 09) pode indicar um vício de linguagem.
III. Ao falar “meter o pé”, Odila deu a entender que era preciso sair do seu bairro o mais rápido possível.
Quais estão corretas?
“Vamos meter o pé”
Por Leandro Prazeres e João da Mata
- Odila tem pouco mais de um metro e meio de altura e o cabelo liso e grisalho, preso para
- trás. O corpo parece frágil, num contraste com as mãos, grossas e fortes da vida na roça nos
- tempos da juventude. Ela diz viver com a pensão equivalente a pouco mais de um salário mínimo,
- advinda da morte do marido, há 21 anos.
- Ela chegou ___ cidade de Estrela há 30 anos, depois que se casou. Teve quatro filhos 🔷 o
- mais novo é Elizandro, que ainda vive com ela. A casa onde criou a família levou décadas para
- ficar como ela queria. “Nós tínhamos uma casinha velha, de madeira, que ganhamos da
- Prefeitura. Nós fomos construindo. Juntamos uns troquinhos daqui e dali e fizemos uma parte
- da casa, em alvenaria”, contou. “A gente foi botando telhado. O piso, fomos pagando em
- prestações. Por último ▲foi feita uma área numa parte para fora, com churrasqueira” e, assim,
- Odila ia descrevendo a casa.
- O bairro Moinhos, onde a casa está localizada, era habitado, em sua maioria, por
- trabalhadores de baixa renda, como Odila. ___ ruas eram, inicialmente, cobertas com
- paralelepípedos, acentuando o ar bucólico do local. As casas eram cercadas por pequenos jardins
- de grama verde e baixa e, nos últimos anos, a prefeitura asfaltou algumas ruas do local. Elizandro
- disse ter uma relação especial com a vizinhança: “Ajudei a construir metade dessa vila”, contou
- com a voz embargada. O bairro já havia sido severamente atingido pela enchente de setembro
- do ano passado. Na ocasião, o Vale do Taquari também foi afetado e, no total, o Rio Grande do
- Sul registrou 54 mortes. O trauma de setembro deixou os moradores da região em estado de
- alerta. “A gente tem medo. O pessoal começou a dizer: ‘Á água está vindo. Á água está vindo’.
- Aí eu disse 🔵 ‘Vamos meter o pé’”, relembrou Odila. Após a decisão de partir, começou outra
- fase de angústia. Como sair de um lugar quando todos querem sair ao mesmo tempo?
- “Quando começou a enchente, nós começamos a reunir as coisas e esperamos o caminhão.
- Ligamos para os caminhões, mas não tinha mais porque eles não podiam socorrer todo mundo.
- Estávamos numa aflição porque sabíamos que a água ia tomar conta”, disse ela. Com a ajuda
- de vizinhos e dos filhos, Odila conseguiu reunir alguns poucos pertences e documentos e foi
- levada para um abrigo improvisado. Elizandro só chegou no abrigo no dia seguinte, pois tentou
- ajudar os vizinhos ___ levar móveis para os pisos superiores das casas. Não adiantou. A água
- encobriu todas as casas, ele contou.
(Disponível em: www.bbc.com/portuguese/articles/cj554e3zgmyo – texto adaptado especialmente para esta prova).
A partir da leitura do texto, assinale a alternativa correta.
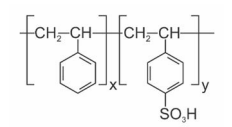
Considerando que a titulação de amostras de 150,00 mg de PS-SPS consumiu, em média, 20,00 mL da solução titulante, assinale o valor que mais se aproxima do grau de sulfonação do PS-SPS, expresso em mol%.
pH = pKa + log([OAc–] / [HOAC])
Com relação a esse exemplo, assinale a alternativa correta.
HInd + H2O → H3O+ + Ind– Ki = [HInd] / [H3O+] . [Ind–]
Sabe-se que o olho humano consegue identificar a mudança de cor quando:
[HInd] = 10[Ind–] cor A [Ind–] = 10[Hind] cor B
Assinale a alternativa que apresenta corretamente o intervalo de pH em que ocorre a mudança de cor de um indicador, cuja Ki = 10-7.