Questões de Concurso
Para químico
Foram encontradas 3.446 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
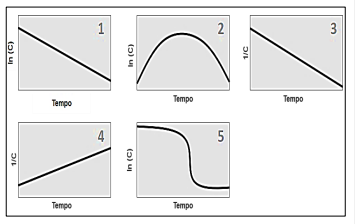
Refere-se a uma equação cinética de primeira ordem o(s) gráfico(s) indicado(s) apenas pelo(s) número(s)
Contudo, a força do hipoclorito como agente desinfetante depende do quantitativo das espécies químicas existentes no equilíbrio. Se 3,0 x 10–5 mol/L de NaOCl forem adicionados em uma solução de pH 7, a porcentagem de espécies OCl– e HOCl presentes no equilíbrio será, respectivamente, de:
(Dados: 10–0,4 = 0,40; 10–0,5 = 0,32; 10–0,6 = 0,25; 10–0,7 = 0,20; e, 10–0,8 = 0,16.)
EDTA + Ca2+ → [Ca . EDTA]complexo
Sabendo que o resultado de dureza é expresso em mg/L de CaCO3, a análise físico-química da referida amostra resultará no valor de dureza total de:
(Dados: massa molar do CaCO3= 100 g/mol.)
Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

I. As medidas potenciométricas apresentam alta sensibilidade, tempo de resposta curto, facilidade de escalonamento e automação; elas funcionam bem com solventes orgânicos; cor e turbidez não são interferentes. II. O método potenciométrico se baseia na medida do potencial de células eletroquímicas, com o consumo apreciável de corrente. III. O eletrodo indicador apresenta corrente que varia de forma conhecida com alterações na concentração do analito. IV. O eletrodo de referência é uma meia-célula que tem um potencial de eletrodo conhecido, que permanece constante sob temperatura constante, independente da composição da solução do analito.
Está correto o que se afirma apenas em
(Dado: log 29 = 1,46.)
I. A extração em fase sólida apresenta algumas vantagens em relação à extração líquido-líquido convencional. Entre elas, menor consumo de solvente orgânico, a não formação de emulsões, facilidade de automação, volumes reduzidos de resíduos tóxicos, capacidade de aumentar seletivamente a concentração do analito. II. A quantidade de amostra e a concentração do analito são fatores fundamentais para a escolha do método analítico, uma vez que a concentração do analito influencia na ocorrência de erros interlaboratoriais. O desvio-padrão relativo aumenta drasticamente quando a concentração do analito na amostra que se encontra entre 1 ppb e 100 ppm passa para a faixa de 0,01% a 1%. III. Durante a preparação das amostras é fundamental a eliminação dos interferentes. Na espectroscopia de emissão atômica em plasma e em chama, as interferências físicas que, geralmente, são específicas a certos analitos ocorrem após a dessolvatação. Estes interferentes influenciam na volatilização das partículas do analito durante a conversão das partículas sólidas ou fundidas em átomos ou íons elementares. IV. A microextração em fase sólida utiliza uma fibra de sílica fundida recoberta com um polímero não-volátil capaz de realizar a extração de analitos orgânicos diretamente de amostras aquosas ou em espaço livre sobre as amostras (headspace). Os analitos são, posteriormente, desorvidos termicamente em injetor de um cromatógrafo a gás. Essa técnica combina a amostragem e a pré-concentração em uma única etapa.
Está correto o que se afirma apenas em
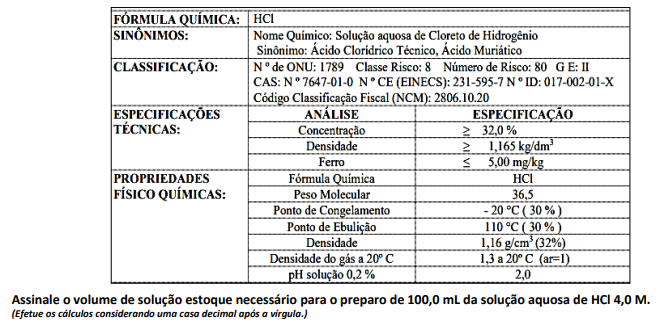
(Efetue os cálculos considerando uma casa decimal após a vírgula.)
I. O dióxido de carbono representa um entre os vários gases reconhecidos pelo Protocolo de Quioto como gases do efeito estufa. II. As emissões de CO2 podem ser quantificadas no ambiente por meio de análise por cromatografia gasosa acoplada a detector de ionização em chama. III. O dióxido de carbono é um anidrido que se dissolve na água, segundo a equação química balanceada: CO2 + H2O → H2CO3. IV. A remoção do CO2 do ambiente pode ser realizada pelas plantas durante a realização da fotossíntese, segundo a equação química balanceada: 6CO2 + 12H2O → C6H12O6 + 6O2 + 6H2O. V. Considerando que as plantas apresentam 90% de eficiência durante a realização da fotossíntese, para a produção de 180 toneladas de glicose será necessário o sequestro de menos de 290 toneladas de CO2.
Está correto o que se afirma apenas em
A questão abaixo se refere ao preparo e à padronização de soluções comumente utilizadas em análises químicas.
As empresas que buscam implementar a ISO 14000 têm como objetivo prover um Sistema de Gestão Ambiental (SGA) eficaz. A Figura 1 demonstra, em linha gerais, as etapas para a implantação do SGA para uma empresa:
Figura 1: Etapas para implementação do SGA com melhoria contínua.

A questão abaixo se refere ao preparo e à padronização de soluções comumente utilizadas em análises químicas.
As empresas que buscam implementar a ISO 14000 têm como objetivo prover um Sistema de Gestão Ambiental (SGA) eficaz. A Figura 1 demonstra, em linha gerais, as etapas para a implantação do SGA para uma empresa:
Figura 1: Etapas para implementação do SGA com melhoria contínua.

I. Em uma padronização, a concentração de uma solução é determinada pela sua titulação contra uma quantidade cuidadosamente medida de um padrão primário. II. O ponto de equivalência é um ponto na titulação, quando ocorre uma alteração física associada à condição de equivalência química. III. O padrão primário é um composto ultrapuro que serve como material de referência para os métodos titulométricos de análise. Ele deve apresentar ausência de água de hidratação e massa molar razoavelmente grande. IV. A precisão indica a proximidade da medida do valor verdadeiro, ou aceito, sendo expressa pelo erro absoluto ou erro relativo.
Está correto o que se afirma apenas em
A questão abaixo se refere ao preparo e à padronização de soluções comumente utilizadas em análises químicas.
As empresas que buscam implementar a ISO 14000 têm como objetivo prover um Sistema de Gestão Ambiental (SGA) eficaz. A Figura 1 demonstra, em linha gerais, as etapas para a implantação do SGA para uma empresa:
Figura 1: Etapas para implementação do SGA com melhoria contínua.

A questão abaixo se refere ao preparo e à padronização de soluções comumente utilizadas em análises químicas.
As empresas que buscam implementar a ISO 14000 têm como objetivo prover um Sistema de Gestão Ambiental (SGA) eficaz. A Figura 1 demonstra, em linha gerais, as etapas para a implantação do SGA para uma empresa:
Figura 1: Etapas para implementação do SGA com melhoria contínua.

I. O processo precisa ser realizado dentro de capela de exaustão por se tratar de um ácido fixo. II. Como o processo de diluição é exotérmico, inicialmente deve-se adicionar a água e, depois, adicionar a solução estoque para minimizar o risco de acidentes. III. A solução aquosa do HCl conduz corrente elétrica uma vez que este é um composto iônico. IV. Nas condições ambientes e na ausência de água, o HCl é classificado como hidreto recebe o nome de cloreto de hidrogênio.
Está correto o que se afirma apenas em