Questões de Concurso
Para químico
Foram encontradas 3.446 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
A estrutura de Lewis para o íon tetrafluoroborato (BF4 − ) é a mostrada a seguir.
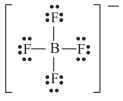
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O físico-químico Gilbert Newton Lewis propôs a regra do
octeto.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O modelo da repulsão dos pares de elétrons da camada de
valência aplicado à molécula SF4 leva à conclusão de que
sua estrutura molecular é piramidal quadrática.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O físico-químico Gilbert Newton Lewis explicou o modelo
das ligações químicas.
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
A maioria dos compostos aromáticos não heterocíclicos não
substituídos apresentam rendimentos quânticos de
fluorescência elevados o suficiente para uma análise bem
sucedida por espectroscopia de fluorescência. Moléculas
com sistemas de vários anéis aromáticos e com estruturas
planares rígidas costumam apresentar alta fluorescência.
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
As bandas de absorção são normalmente muito mais amplas
nos espectro de UV-VIS que nos de infravermelho (IV).
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
Vários tipos de transições entre níveis de energia
quantizados dão origem aos espectros moleculares de
UV-VIS, entre as quais se destacam as transições n → π* e
π → π*, porque envolvem grupos funcionais característicos
das substâncias e comprimentos de onda que são facilmente
acessíveis.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Se a curva de titulação tivesse apenas um ponto de inflexão
negativa, então seria correto concluir que a amostra conteria
apenas NaOH.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Ácidos fracos podem ser determinados por titulometria de
neutralização, mas não os ânions deles derivados.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
É adequado utilizar púrpura de bromocresol e azul de timol
como indicadores, do primeiro e do segundo pontos de
equivalência, respectivamente.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
A amostra em apreço contém apenas NaOH e Na2CO3.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
Uma das vantagens de utilizar EDTA como agente
complexante em volumetria de complexação é que ele é um
quelante muito seletivo.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
O intervalo de confiança para 95% de certeza da análise
dessas replicatas é corretamente expresso como
10,79 (± 0,01) %.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
A diferença observada entre o valor tido como verdadeiro e a
média experimental é significativa e deve ser atribuída a um
erro constante.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
Em volumetria de complexação, o indicador forma um
segundo complexo com o analito, que normalmente é
colorido. Quando o titulante é adicionado, ele complexa
primeiro com o metal livre na solução até que este acabe. Ele
passa então a deslocar o metal complexado com o indicador,
alterando a cor da solução e indicando o ponto final da
titulação.
Acerca de métodos eletroquímicos de análise, julgue o item que se segue.
A voltametria de redissolução anódica é um método adequado para determinação da especiação de metais em águas naturais, porém essa técnica não consegue distinguir a forma química exata de alguns metais-traço que se apresentam como espécies estreitamente relacionadas — por exemplo, Pb2+ e PbCl+ fornecem um pico único de redissolução.
Acerca de métodos eletroquímicos de análise, julgue o item que se segue.
Um dos problemas da utilização do mercúrio como eletrodo
de trabalho é a existência de picos em curvas de
corrente-voltagem, denominados máximos polarográficos,
atribuídos à convecção que ocorre nas adjacências da gota de
mercúrio crescente. A adição de pequenas quantidades de um
tensoativo à solução de análise normalmente elimina esses
máximos. Porém, é preciso ter cuidado, pois o excesso de
supressor de máximos pode alterar a viscosidade da solução
e reduzir as correntes de difusão necessárias para o bom
funcionamento do eletrodo.
Acerca de métodos eletroquímicos de análise, julgue o item que se segue.
Em potenciometria, é necessário o uso de três eletrodos: o
eletrodo de trabalho, o eletrodo de referência e o eletrodo
auxiliar.
Acerca de métodos eletroquímicos de análise, julgue o item que se segue.
A fim de diminuir o tempo de análise, que é um fator
importante na escolha e na concepção dos métodos
analíticos, a coulometria de potencial controlado é
normalmente realizada em células eletroquímicas de grande
volume, usando-se eletrodos de trabalho com áreas de
superfície pequenas e com altas taxas de agitação.

Entre as atividades desenvolvidas nos laboratórios da UnB, inclui-se a análise de aminoácidos (AAA). A figura precedente mostra um cromatograma de uma AAA obtido nas seguintes condições de análise.
• coluna: Shim-pack XR-ODS de fase reversa (3,0 mm d.i.; 75 mm)
• temperatura: 40 °C
• fase móvel: 10 mmol/L de fosfato de potássio (pH 7,0) e acetonitrila, eluição por gradiente
• fluxo: 1,2 mL/min
• detecção: 254 nm
Os picos do cromatograma correspondem aos seguintes analitos, representados pelo código internacional de três letras para aminoácidos (com exceção do íon amônio).
1. Asp 10. amônio
2. Glu 11. Tyr
3. Ser 12. Val
4. Gly 13. Met
5. His 14. Cys
6. Arg 15. Ile
7. Thr 16. Leu
8. Ala 17. Phe
9. Pro 18. Lys
Nessa análise, os aminoácidos são convertidos em
derivados de feniltiocarbamil (PTC, em inglês) por derivatização
pré-coluna utilizando o reagente isotiocianato de fenila (PITC,
em inglês).
Considerando essas informações, julgue o item a seguir.
O método analítico apresentado no texto permite realizar tanto uma análise qualitativa quanto uma análise quantitativa.