Questões de Concurso
Para especialista em regulação - qualquer área de formação
Foram encontradas 639 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
No ato do protocolo do pedido de registro, deverão ser
apresentados um plano de farmacovigilância e um plano de
minimização de risco.
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
A solicitação deve se basear na regulamentação vigente para
o registro de fitoterápicos, ou seja, medicamentos obtidos
empregando-se matérias-primas vegetais.
No que concerne às boas práticas de fabricação complementares às atividades de qualificação e validação, julgue o item a seguir.
A execução repetida dos processos de limpeza e dos testes de
detecção até a obtenção de um resultado satisfatório não é
considerada uma abordagem aceitável de validação de
limpeza.
No que concerne às boas práticas de fabricação complementares às atividades de qualificação e validação, julgue o item a seguir.
Os lotes fabricados para a validação de processo podem ser
personalizados quando comparados aos lotes de escala
comercial pretendidos.
No que concerne às boas práticas de fabricação complementares às atividades de qualificação e validação, julgue o item a seguir.
A validação prospectiva é realizada antes da produção de
lotes comerciais; já a validação retrospectiva envolve a
avaliação da experiência passada de produção, sob a
condição de que a composição, os procedimentos e os
equipamentos permaneçam inalterados.
Um centro de pesquisa clínica no Brasil foi contratado
para realizar um estudo clínico, patrocinado por uma indústria
farmacêutica, para avaliação de uma nova forma farmacêutica
para tratamento da hipertensão arterial, seguindo regulamentação
padrão da ANVISA no que se refere a responsabilidades. O
protocolo foi aprovado em 10 de janeiro de 2023 pelo
competente comitê de ética em pesquisa, e todos os documentos
pertinentes foram aprovados pela ANVISA no prazo de 90 dias
corridos. O primeiro participante foi incluído no estudo clínico
em 10 de maio do mesmo ano. Após a administração do novo
medicamento em cinco participantes, foi realizada a inclusão de
um novo desfecho secundário ao protocolo, para avaliar o
impacto do medicamento no bem-estar emocional dos pacientes e
na sua qualidade de vida, utilizando-se questionários validados
específicos. No decorrer do estudo, um participante apresentou
hipotensão, tontura e perda de consciência, o que demandou sua
hospitalização e a administração de fluidos intravenosos a ele.
Foi estabelecida relação de causalidade entre esse ocorrido e a
administração da medicação-teste.
Considerando essa situação hipotética, julgue o item a seguir.
O caso relatado de tontura representa, por definição, um
evento adverso grave.
Um centro de pesquisa clínica no Brasil foi contratado
para realizar um estudo clínico, patrocinado por uma indústria
farmacêutica, para avaliação de uma nova forma farmacêutica
para tratamento da hipertensão arterial, seguindo regulamentação
padrão da ANVISA no que se refere a responsabilidades. O
protocolo foi aprovado em 10 de janeiro de 2023 pelo
competente comitê de ética em pesquisa, e todos os documentos
pertinentes foram aprovados pela ANVISA no prazo de 90 dias
corridos. O primeiro participante foi incluído no estudo clínico
em 10 de maio do mesmo ano. Após a administração do novo
medicamento em cinco participantes, foi realizada a inclusão de
um novo desfecho secundário ao protocolo, para avaliar o
impacto do medicamento no bem-estar emocional dos pacientes e
na sua qualidade de vida, utilizando-se questionários validados
específicos. No decorrer do estudo, um participante apresentou
hipotensão, tontura e perda de consciência, o que demandou sua
hospitalização e a administração de fluidos intravenosos a ele.
Foi estabelecida relação de causalidade entre esse ocorrido e a
administração da medicação-teste.
Considerando essa situação hipotética, julgue o item a seguir.
O desfecho secundário citado representa uma emenda ao
protocolo apta à imediata implementação, pois, uma vez
utilizados questionários validados, é desnecessária aprovação
ética adicional.
Um centro de pesquisa clínica no Brasil foi contratado
para realizar um estudo clínico, patrocinado por uma indústria
farmacêutica, para avaliação de uma nova forma farmacêutica
para tratamento da hipertensão arterial, seguindo regulamentação
padrão da ANVISA no que se refere a responsabilidades. O
protocolo foi aprovado em 10 de janeiro de 2023 pelo
competente comitê de ética em pesquisa, e todos os documentos
pertinentes foram aprovados pela ANVISA no prazo de 90 dias
corridos. O primeiro participante foi incluído no estudo clínico
em 10 de maio do mesmo ano. Após a administração do novo
medicamento em cinco participantes, foi realizada a inclusão de
um novo desfecho secundário ao protocolo, para avaliar o
impacto do medicamento no bem-estar emocional dos pacientes e
na sua qualidade de vida, utilizando-se questionários validados
específicos. No decorrer do estudo, um participante apresentou
hipotensão, tontura e perda de consciência, o que demandou sua
hospitalização e a administração de fluidos intravenosos a ele.
Foi estabelecida relação de causalidade entre esse ocorrido e a
administração da medicação-teste.
Considerando essa situação hipotética, julgue o item a seguir.
Conforme regulamentação da ANVISA, a data de início do
ensaio clínico no caso em tela é 10 de maio de 2023, quando
houve a inclusão do primeiro participante.
Um centro de pesquisa clínica no Brasil foi contratado
para realizar um estudo clínico, patrocinado por uma indústria
farmacêutica, para avaliação de uma nova forma farmacêutica
para tratamento da hipertensão arterial, seguindo regulamentação
padrão da ANVISA no que se refere a responsabilidades. O
protocolo foi aprovado em 10 de janeiro de 2023 pelo
competente comitê de ética em pesquisa, e todos os documentos
pertinentes foram aprovados pela ANVISA no prazo de 90 dias
corridos. O primeiro participante foi incluído no estudo clínico
em 10 de maio do mesmo ano. Após a administração do novo
medicamento em cinco participantes, foi realizada a inclusão de
um novo desfecho secundário ao protocolo, para avaliar o
impacto do medicamento no bem-estar emocional dos pacientes e
na sua qualidade de vida, utilizando-se questionários validados
específicos. No decorrer do estudo, um participante apresentou
hipotensão, tontura e perda de consciência, o que demandou sua
hospitalização e a administração de fluidos intravenosos a ele.
Foi estabelecida relação de causalidade entre esse ocorrido e a
administração da medicação-teste.
Considerando essa situação hipotética, julgue o item a seguir.
Na situação apresentada, os custos de hospitalização do
participante são de responsabilidade do investigador — no
caso, o centro de pesquisa clínica onde era realizado o
estudo.
Sobre epidemiologia, pesquisa clínica e tecnologias em saúde, julgue o item a seguir.
No sistema GRADE (Grading of Recommendations
Assessment, Development and Evaluation), um nível de
evidência alto implica que é improvável que trabalhos
adicionais futuros não modifiquem a confiança na estimativa
do efeito; já no nível baixo, trabalhos futuros poderão
modificar a confiança na estimativa de efeito, podendo,
inclusive, modificar a estimativa.
Sobre epidemiologia, pesquisa clínica e tecnologias em saúde, julgue o item a seguir.
Uma tecnologia em saúde é classificada como experimental
quando está submetida a testes em laboratório que usem
animais ou outros modelos, e como investigacional quando
está submetida a avaliações clínicas iniciais em humanos.
Sobre epidemiologia, pesquisa clínica e tecnologias em saúde, julgue o item a seguir.
Em um relatório de estudos de coorte, devem ser
obrigatoriamente descritos o ambiente, os locais e as datas
relevantes, incluindo-se os períodos de recrutamento,
exposição, acompanhamento e coleta de dados.
Sobre epidemiologia, pesquisa clínica e tecnologias em saúde, julgue o item a seguir.
A incidência diz respeito somente ao número de casos
existentes de uma doença, enquanto a prevalência é a
frequência com que surgem novos casos de uma doença em
um determinado período de tempo.
O paracetamol é considerado um pró-fármaco, uma vez que
é metabolizado no sistema nervoso central e o produto desta
metabolização é capaz de se ligar a receptores específicos.
O paracetamol (acetaminofeno), um fármaco com parâmetros farmacocinéticos bem determinados, é o antitérmico escolhido nos protocolos médicos adotados para os pacientes com dengue. Acerca do paracetamol, julgue o próximo item.
O paracetamol apresenta baixa interação com proteínas
plasmáticas, sendo a albumina a principal proteína capaz de
se ligar irreversivelmente ao fármaco, além de diminuir a
atividade biológica deste nos sítios de atuação.
O paracetamol (acetaminofeno), um fármaco com parâmetros farmacocinéticos bem determinados, é o antitérmico escolhido nos protocolos médicos adotados para os pacientes com dengue. Acerca do paracetamol, julgue o próximo item.
O paracetamol é absorvido por difusão — cuja taxa depende
do gradiente de concentração e da polaridade do fármaco —,
que é realizada da região com maior concentração para a de
menor concentração.
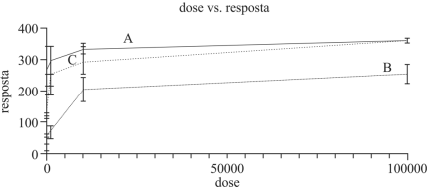
Com relação à interação dos três fármacos A, B e C com o paciente que pode vir a recebê-los, julgue o item a seguir.
O aumento da dose do fármaco B, que possui um índice
terapêutico pequeno, aumenta a possibilidade de toxicidade
do fármaco.

Com relação à interação dos três fármacos A, B e C com o paciente que pode vir a recebê-los, julgue o item a seguir.
Um anticorpo tanto pode ser classificado como um antagonista competitivo do agonista como pode atuar inibindo a ação do agonista sem se ligar a um receptor classificado como antagonista fisiológico.
Julgue o item a seguir, relativos a fiscalização e controle sanitário.
Uma infração sanitária é considerada grave quando é
verificada a existência de duas ou mais circunstâncias
agravantes.
Julgue o item a seguir, relativos a fiscalização e controle sanitário.
Servidores da ANVISA podem exercer o poder de polícia e
têm prerrogativas para inutilizar unidades de produtos cuja
adulteração ou deterioração seja flagrante.