Questões de Concurso
Para técnico
Foram encontradas 10.566 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
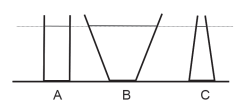
A relação entre as pressões no fundo de cada um deles é descrita por
O módulo, em newtons, e o sentido da força elétrica sentida pela partícula A devido à partícula B são, respectivamente,
Dado constante elétrica k = 9,0 . 109 N m2 /C2
Logo após entrar nessa região, esse feixe de elétrons é
A energia interna de um gás ideal diatômico depende apenas de sua temperatura. Esse gás ideal passa por um processo isotérmico, em contato com uma fonte térmica à temperatura T. Observa-se que ele realiza um trabalho total de 350 J sobre o meio ambiente.
O calor trocado pelo gás com a fonte térmica T é igual a
Qual é a diferença de potencial, em kV, na qual esse acelerador opera?
Dado carga elétrica do próton = 1,6 . 10-19 C massa do próton = 1,7 . 10-27 kg
Um cilindro longo de um material de condutividade térmica k, comprimento L e raio da seção reta R, está colocado entre uma fonte fria à temperatura TF e uma fonte quente à temperatura TQ. O fluxo estacionário de calor que passa por esse cilindro é J1 . Um outro cilindro, feito de outro material, com condutividade térmica k/2, comprimento 4L e raio de seção reta 4R, é colocado entre as mesmas fontes, fria e quente. Para esse segundo cilindro, o fluxo estacionário de calor é J2 .
A relação entre os fluxos estacionários de calor, J2 /J1 , é igual a
H2 N-CH2 -CH2 -CH2 -CH2 -NH2(aq) + 2 H+ (aq) ⇌ +H3 N-CH2 -CH2 -CH2 -CH2 -NH3 + (aq)
Nesse sistema, verifica-se que o(a)
Baseado no tamanho e no grau de espalhamento de luz incidente, calculou-se em 1 × 10-5 mol L-1 a concentração de AgNP na dispersão. A partir do tamanho médio, determinou-se que haveria 500 átomos de Ag por nanopartícula.
Considerando-se esses dados, verifica-se que a massa de prata, em mg, presente em 1 mL de dispersão é
Dado 1 mol = 6 x 1023 unidades M (Ag) = 108 g mol-1
NaHCO3(s) + H3 O+ (aq) → Na+ (aq) + 2H2 O(l) + CO2(g)
Considerando-se a proporção estequiométrica e o rendimento completo de reação, a massa de bicarbonato de sódio necessária para neutralizar 20,0 L de solução aquosa, cujo pH medido foi 2, é
A concentração, em mol L-1 , do hidróxido na solução é
Dado M(NaOH) = 40 g mol-1
A concentração do princípio ativo, em g L-1 , dessa solução final é, aproximadamente,
CaCO3(s) → CaO(s) + CO2(g); ΔH0 = +179 kJ
Considerando-se o comportamento ideal do gás e o rendimento máximo da reação, a energia necessária, em MJ, para produzir 36 m3 de CO2 , medido nas condições normais de temperatura e pressão (CNTP) é, aproximadamente,
Dado R × T = 24,4 atm L mol-1 M = 106
Sobre essa reação, verifica-se que o
S(s) + O2(g) → SO2(g)
A reação do enxofre foi completa, e a massa da matéria prima era 80,0 kg.
A partir dessa informação, a percentagem, em massa, de enxofre elementar na matéria prima é, aproximadamente,
Dado R = 0,082 atm L mol-1 K-1
O recipiente cilíndrico de diâmetro igual a 12 m, representado na Figura abaixo, é aberto no topo e contém água, cuja densidade é igual a 1.000 kg/m3 , até a linha indicada. O nível da água no interior do reservatório está a uma altura h1 = 10,8 m, e a tubulação de saída, um duto circular com 20 cm2 de área de seção reta, está a uma altura h2 = 9 m.
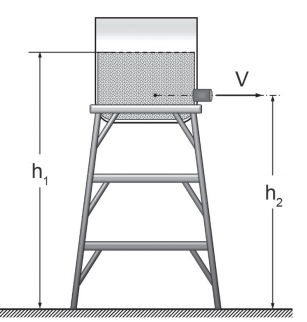
Dado
g = 10 m/s2
Considerando-se a situação apresentada, a vazão de saída de água, em kg/s, é igual a
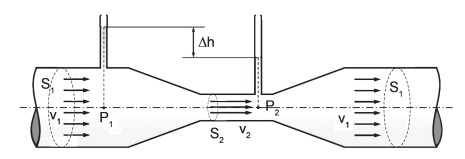
Esse dispositivo é usado para medir
Trata-se do conceito de condições de