Questões de Concurso
Para química
Foram encontradas 13.134 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
( ) Em 1913, Bohr propôs um modelo no qual os elétrons orbitam o núcleo, porém com uma órbita definida e particular. Bohr conhecia os trabalhos de Planck e Einstein. Em seu modelo, os elétrons ocupam estados estacionários de energia fixa. Os elétrons podem realizar saltos quânticos de um estado de energia para outro em que é liberado um fóton.
( ) O físico inglês J. J. Thomson usou o tubo de raios catódicos e seu conhecimento da teoria eletromagnética para determinar a razão entre a carga elétrica e a massa de um elétron.
( ) O modelo atômico de Dalton propôs que a matéria é constituída de minúsculas partículas, como uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga.
( ) Thomson propôs que um átomo podia ser imaginado como uma esfera com carga positiva uniforme de matéria, na qual os elétrons estão embutidos como passas em um bolo. Esse modelo chamado de “pudim de passas” foi a teoria aceita durante muitos anos.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
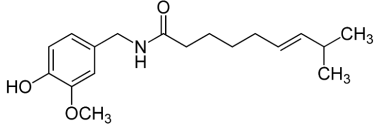
I. Apresenta as funções cetona e amina em sua estrutura.
II. Possui oito átomos de carbono com hibridização sp2 .
III. Apresenta dois carbonos terciários, oito carbonos secundários e dois carbonos primários.
IV. Possui três átomos de carbono com hibridização sp.
V. Apresenta fórmula molecular C18H27NO3.
Quais estão corretas?
Assinale a alternativa que preenche CORRETAMENTE a lacuna.
Em uma titulação de neutralização é possível a representação gráfica do ponto final da titulação (pH x
titulante). Em uma titulação de NH4OH com HCl, o gráfico que representa a curva de titulação dessa
reação é
KIO3 + 5 KI + 6 HCl → 3I2 + 3 H2O + 6 KCl I2 + 2 Na2S2O3 → Na2S4O6 + 2I- + 2Na+
O fator de correção que será utilizado para futuros cálculos envolvendo a solução preparada pelo aluno será de, aproximadamente,

De acordo com essas informações, é correto afirmar que as concentrações molares dos ácidos clorídrico e nítrico são respectivamente, de
4Fe(s) + 3O2(g) + 2H2O(l) → 2Fe2O3.H2O(s)
Uma das maneiras de evitar esse fenômeno é

O volume do ácido sulfúrico concentrado necessário para preparar a solução solicitada pelo professor foi de, aproximadamente,
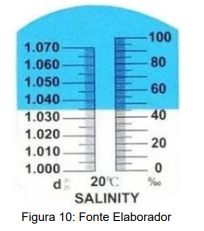
Conforme a leitura realizada, é correto afirmar que a concentração de sais dissolvidos na água é de, aproximadamente,
C3H6O3 + NaOH → Na(C3H5O3) + H2O
KMnO4 + H2SO4 + CH3CH2OH → K2SO4 + MnSO4 + CH3CHO + H2O + calor
A soma dos coeficientes, após o balanceamento, é de