Questões de Concurso
Para química
Foram encontradas 13.461 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Julgue o item que se segue.
A sacarose sofre redução quando é inserida em uma
solução básica contendo KMnO4, convertendo a hidroxila
em ácido carboxílico.
Julgue o item que se segue.
A fotoconversão de espécies cloradas como o nitrato de
cloro (ClONO2), em espécies químicas muito reativas
conhecidas por radicais, contribui com a manutenção da
camada de ozônio.
Julgue o item que se segue.
As gorduras e óleos são misturas de triacilgliceróis,
também chamados de triglicerídeos.
Julgue o item que se segue.
Os lipídios, devido à sua baixa polaridade, interagem bem
com as cadeias alquílicas dos detergentes formando
nanoestruturas conhecidas como micelas.
Julgue o item que se segue.
A hidrólise das gorduras resulta no glicerol e em ácidos
graxos de cadeia longa. Assim, a hidrólise da triestearina
fornece duas moléculas de glicerol e uma molécula de
ácido esteárico.
Julgue o item que se segue.
A hibridização do tipo sp³d² apresenta seis orbitais
híbridos e gera uma molécula com geometria octaédrica.
Julgue o item que se segue.
Os triacilgliceróis são substâncias nas quais os três
grupos hidroxila do glicerol são esterificados com ácido
acético (CH3 - COOH).
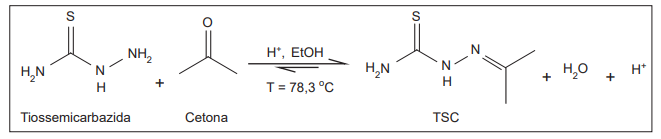
Considerando-se esse esquema reacional, a reação orgânica utilizada na obtenção da TSC é a
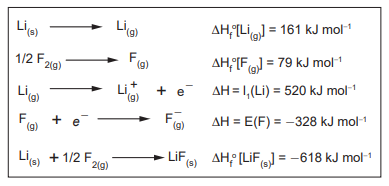
Nesse contexto, o valor aproximado da entalpia de rede (ΔHrede) para o LiF(s), em kJ mol-1 , é
Nesse contexto, o valor aproximado do comprimento de ligação para C–S é
Dado raio covalente para H = 0,31 A
Nesse contexto, o resultado qualitativo obtido é a presença do íon
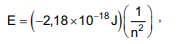
onde E é a energia da órbita permitida para um elétron no átomo de hidrogênio, em Joule, e n representa o número quântico principal que assume valores inteiros de 1, 2, 3, ... ∞ .
Dessa forma, com base nesse modelo atômico, para Bohr a(o)
Nessa abordagem, no caso de uma titulação redox monitorada com um eletrodo combinado, graficamente obtém-se a(o)
Em termos comparativos, em relação às outras duas substâncias, a banda espectral de
Dado F = 96.500 C mol-1
Dentre esses procedimentos, o único que NÃO se adapta a esses preceitos é a
A lei de velocidade dessa reação, nas condições mencionadas, é a
8Al (s) + 3Fe3 O4(s) = 9Fe(s) + 4Al 2 O3(s) + CALOR
Considere 100,0 g de alumínio de soldagem com pureza de 81% e que a reação tem 75% de rendimento, por causa da troca de calor com o ambiente.
A quantidade de ferro, em gramas, formada nesse processo é, aproximadamente, de
A quantidade mais próxima, em milimol, de cobre nessa alíquota de solução é igual a