Questões de Concurso
Para engenharia química
Foram encontradas 2.418 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
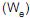 como trabalho de eixo, a equação que expressa a primeira lei da termodinâmica para um processo com escoamento, em estado estacionário, entre uma única entrada e uma única saída, em que as variações de energia cinética e potencial são desprezíveis, é
como trabalho de eixo, a equação que expressa a primeira lei da termodinâmica para um processo com escoamento, em estado estacionário, entre uma única entrada e uma única saída, em que as variações de energia cinética e potencial são desprezíveis, é U + PV e G
U + PV e G H - TS, em que:
H - TS, em que:H = entalpia molar;
G = energia livre de Gibbs molar;
S = entropia molar;
P = pressão;
T = temperatura;
V = volume molar,
para este processo de compressão, conclui-se que
1. de um estado inicial a 100 o C e 1 bar, é comprimido adiabaticamente até 150 o C;
2. em seguida, é resfriado de 150 o C a 100 o C, a pressão constante;
3. finalmente, é expandido isotermicamente até o seu estado original.
Para o ciclo completo, as variações de energia interna (?U) e entalpia (?H) são
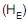 e a energia interna específica do gás no interior do tanque, após o enchimento (U), é
e a energia interna específica do gás no interior do tanque, após o enchimento (U), é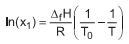
Sabe-se que:
• X1 é a fração molar de solvente em solução que cristaliza na temperatura T;
• ΔfH e T0 são, respectivamente, a variação de entalpia e a temperatura de fusão do solvente puro;
• R é a constante universal dos gases que pode ser aproximada por 2 cal/(mol•K);
• a variação de entropia de fusão do benzeno puro é 8 cal/(mol•K);
• a massa molar do benzeno é 78 g/mol;
• a temperatura de fusão do benzeno (T0) é 278,5 K.
A massa molar do soluto, a 278 K, necessária para a cristalização do benzeno a partir de uma solução de 10 g de soluto em 780 g de benzeno, em g/mol, é
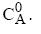
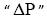 é a queda de pressão no equipamento (mantida constante), "fc" é a fração volumétrica de sólidos na torta,
é a queda de pressão no equipamento (mantida constante), "fc" é a fração volumétrica de sólidos na torta, 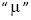 é a viscosidade do fluido e "A" é a área da seção reta do filtro. Assinale a alternativa que contém a expressão correta para o volume de filtrado em função do tempo "t".
é a viscosidade do fluido e "A" é a área da seção reta do filtro. Assinale a alternativa que contém a expressão correta para o volume de filtrado em função do tempo "t". 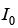 a radiação incidente, I a radiação transmitida, c a concentração do material em estudo,
a radiação incidente, I a radiação transmitida, c a concentração do material em estudo,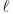 o caminho percorrido no interior da solução e
o caminho percorrido no interior da solução e 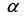 a absortividade da substância, assinale a alternativa que apresenta corretamente a expressão da Lei de Lambert-Beer.
a absortividade da substância, assinale a alternativa que apresenta corretamente a expressão da Lei de Lambert-Beer.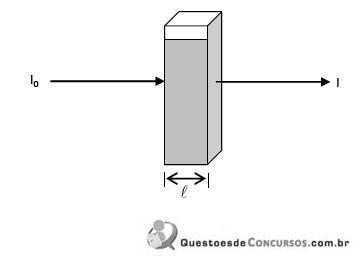
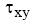 é a tensão de cisalhamento,
é a tensão de cisalhamento, 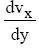 é o gradiente de velocidade e
é o gradiente de velocidade e 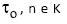 são parâmetros empíricos)
são parâmetros empíricos) 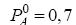 bar e a pressão de saturação de B puro é
bar e a pressão de saturação de B puro é 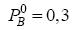 bar. Se a fração molar do componente A na fase líquida é 0,7, assinale a alternativa que representa corretamente a pressão de ponto de bolha e a fração molar de A na fase vapor, respectivamente.
bar. Se a fração molar do componente A na fase líquida é 0,7, assinale a alternativa que representa corretamente a pressão de ponto de bolha e a fração molar de A na fase vapor, respectivamente.Considere fase líquida solução ideal e fase vapor gás ideal.
ESTUDO DE CASO
O diagrama do processo a ser implantado está representado abaixo.
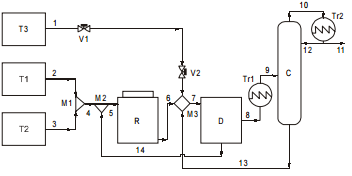
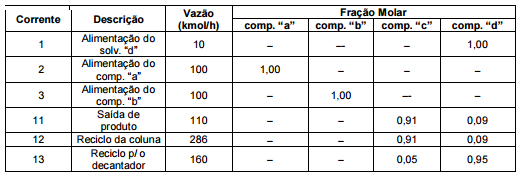
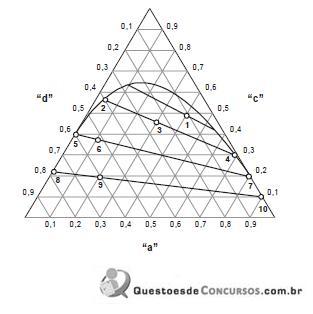
Os componentes a e b estão estocados nos tanques T1 e T2 respectivamente. Depois de misturados em temperatura ambiente a corrente resultante (4) é misturada com uma corrente de reciclo (14) e alimentada no reator (corrente 5). Na reação, todo componente b presente no reator é consumido. A saída do reator (corrente 6) é então misturada com um solvente (componente d), proveniente do tanque de estocagem T3 e da saída do reciclo proveniente da coluna de destilação C, e alimentada no decantador D (corrente 7). Os componentes d e a são totalmente imiscíveis e o componente c particiona preferencialmente para fase rica no componente d seguindo para a destilação (correntes 8 e 9). A fase de fundo do decantador, rica no componente a, é reciclada para o reator (corrente 14). Na destilação os componentes c e d são separados, a corrente mais pesada, rica em d (corrente 13) é reciclada para a entrada do decantador. A corrente 11 é a corrente de produto do processo. As concentrações das correntes de entrada e saída do processo, bem como as correntes da coluna de destilação estão descritas na tabela abaixo
ESTUDO DE CASO
O diagrama do processo a ser implantado está representado abaixo.

Os componentes a e b estão estocados nos tanques T1 e T2 respectivamente. Depois de misturados em temperatura ambiente a corrente resultante (4) é misturada com uma corrente de reciclo (14) e alimentada no reator (corrente 5). Na reação, todo componente b presente no reator é consumido. A saída do reator (corrente 6) é então misturada com um solvente (componente d), proveniente do tanque de estocagem T3 e da saída do reciclo proveniente da coluna de destilação C, e alimentada no decantador D (corrente 7). Os componentes d e a são totalmente imiscíveis e o componente c particiona preferencialmente para fase rica no componente d seguindo para a destilação (correntes 8 e 9). A fase de fundo do decantador, rica no componente a, é reciclada para o reator (corrente 14). Na destilação os componentes c e d são separados, a corrente mais pesada, rica em d (corrente 13) é reciclada para a entrada do decantador. A corrente 11 é a corrente de produto do processo. As concentrações das correntes de entrada e saída do processo, bem como as correntes da coluna de destilação estão descritas na tabela abaixo

ESTUDO DE CASO
O diagrama do processo a ser implantado está representado abaixo.

Os componentes a e b estão estocados nos tanques T1 e T2 respectivamente. Depois de misturados em temperatura ambiente a corrente resultante (4) é misturada com uma corrente de reciclo (14) e alimentada no reator (corrente 5). Na reação, todo componente b presente no reator é consumido. A saída do reator (corrente 6) é então misturada com um solvente (componente d), proveniente do tanque de estocagem T3 e da saída do reciclo proveniente da coluna de destilação C, e alimentada no decantador D (corrente 7). Os componentes d e a são totalmente imiscíveis e o componente c particiona preferencialmente para fase rica no componente d seguindo para a destilação (correntes 8 e 9). A fase de fundo do decantador, rica no componente a, é reciclada para o reator (corrente 14). Na destilação os componentes c e d são separados, a corrente mais pesada, rica em d (corrente 13) é reciclada para a entrada do decantador. A corrente 11 é a corrente de produto do processo. As concentrações das correntes de entrada e saída do processo, bem como as correntes da coluna de destilação estão descritas na tabela abaixo

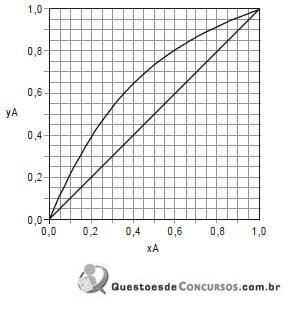
ESTUDO DE CASO
O diagrama do processo a ser implantado está representado abaixo.

Os componentes a e b estão estocados nos tanques T1 e T2 respectivamente. Depois de misturados em temperatura ambiente a corrente resultante (4) é misturada com uma corrente de reciclo (14) e alimentada no reator (corrente 5). Na reação, todo componente b presente no reator é consumido. A saída do reator (corrente 6) é então misturada com um solvente (componente d), proveniente do tanque de estocagem T3 e da saída do reciclo proveniente da coluna de destilação C, e alimentada no decantador D (corrente 7). Os componentes d e a são totalmente imiscíveis e o componente c particiona preferencialmente para fase rica no componente d seguindo para a destilação (correntes 8 e 9). A fase de fundo do decantador, rica no componente a, é reciclada para o reator (corrente 14). Na destilação os componentes c e d são separados, a corrente mais pesada, rica em d (corrente 13) é reciclada para a entrada do decantador. A corrente 11 é a corrente de produto do processo. As concentrações das correntes de entrada e saída do processo, bem como as correntes da coluna de destilação estão descritas na tabela abaixo
