Questões de Concurso
Para engenharia química
Foram encontradas 2.540 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A cromatografia é um método físico-químico de separação, identificação e quantificação de componentes de uma mistura e seu uso é difundido em diversas áreas, inclusive na área forense. Tendo em vista que esse método pode ser executado de diferentes maneiras, julgue o seguinte item.
A cromatografia líquida com fase normal é aquela em que a
fase estacionária é mais polar do que a fase móvel, enquanto
que a cromatografia com fase reversa é aquela em que a fase
móvel é mais polar.
O estado físico da fase estacionária define as cromatografias gasosa, líquida e supercrítica.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
Quando um estado excitado singleto decai para o estado
fundamental, o rendimento quântico de emissão depende
apenas do somatório dos rendimentos quânticos de absorção e
emissão.
Tendo em vista que, do ponto de vista prático, a quimiometria permite planejar ou selecionar condições ótimas de medidas e experimentos e, com isso, extrair o máximo de informação de dados químicos, julgue o item seguinte, relativo a esse assunto e a aspectos a ele correlacionados.
A calibração multivariada por mínimos quadrados parciais para
análise discriminante, ou PLS, é um método supervisionado
que não exige o uso de amostras conhecidas para o seu
treinamento.
Tendo em vista que, do ponto de vista prático, a quimiometria permite planejar ou selecionar condições ótimas de medidas e experimentos e, com isso, extrair o máximo de informação de dados químicos, julgue o item seguinte, relativo a esse assunto e a aspectos a ele correlacionados.
A análise das componentes principais é um método de
decomposição de matrizes cujo resultado permite agrupar
amostras com características similares e discriminar amostras
com características distintas.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 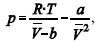 julgue o item que segue.
julgue o item que segue.
A partir do gráfico apresentado, conclui-se que o CO2 (g)
apresenta a constante b na equação de van der Waals inferior
à do O2 (g).

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 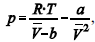 julgue o item que segue.
julgue o item que segue.
Quando atingida a pressão de 300 atm e a temperatura T2, o
volume ocupado pelo gás será menor do que aquele que seria
ocupado, nas mesmas condições, por um gás ideal.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 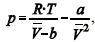 julgue o item que segue.
julgue o item que segue.
A uma pressão de 1,00 atm e temperatura de 300 K, o volume
ocupado pelo O2 (g) formado na decomposição de 4,00 mol de
H2O2 será superior a 46,0 L.
2 NO(g) + 2 H2(g) → N2(g) + 2 H2O(g)
foram determinadas em diferentes experimentos, nos quais as concentrações iniciais dos reagentes ([NO]0 e [H2]0) eram variadas.
Os resultados estão resumidos na tabela a seguir.
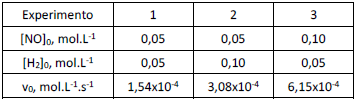
Nas condições deste experimento, a lei de velocidade da reação é
Nos ecossistemas brasileiros este processo pode interferir na estabilidade relativa do corpo d’água provocando
A velocidade de decomposição desse inseticida (nesta temperatura, em mol. L-1. ano-1), quando sua concentração em um corpo d’água for 5,00x10-9 mol.L -1 , será de
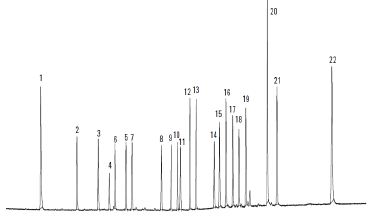
A separação foi feita usando uma coluna não polar, constituída por 100 % de dimetil polisiloxano. Neste cromatograma os picos que correspondem ao DDT e seus resíduos podem ser identificados entre 12, 15 e 17.
Dados: fórmulas moleculares de DDT, DDE e DDD.
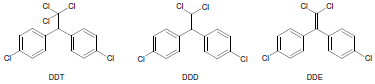
Considerando as estruturas e a composição da coluna cromatográfica, pode-se dizer que os picos 12, 15 e 17 referem-se, respectivamente, a
O princípio fundamental da técnica consiste na medida da absorção da intensidade de radiação eletromagnética, proveniente de uma fonte de radiação primária, por
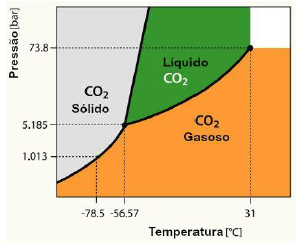
Observe o gráfico que demonstra a região de duas fases e a continuidade dos estados.
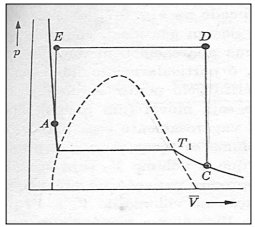
De acordo com a figura anterior, analise as afirmativas a seguir.
I. Os pontos A e C pertencem à mesma isoterma.
II. O ponto C representa um estado gasoso e o ponto A um sólido obtido comprimindo-se o gás isotermicamente.
III. A reta EA mostra quando o volume é mantido constante e o gás é resfriado, diminuindo a pressão.
IV. Em nenhum instante dessa série de mudanças o ponto que representa o estado do gás passou através da região de duas fases.
Estão corretas as afirmativas
Afirma-se que ΔG é o critério básico de espontaneidade. Uma reação ocorre espontaneamente se ΔG tem valor negativo. Lembrando que por tratamento termodinâmico, a fórmula da variação da energia livre padrão é definida por: ΔGo = – RT ln K. Se substituirmos R por 8,31 x 10–3 (quilojoules por Kelvin) e ln K por 2,30 log10 K, tem-se a seguinte fórmula descrita:
ΔGo (em quilojoules) = –2,30(8,31 x 10–3 )T log10K = –0,0191T log10K
Assinale a alternativa que NÃO contempla a energia livre padrão em sua fórmula substituída:
Sendo (pf ,Tf ), respectivamente, a pressão e a temperatura ao fim do processo acima, podem ser escritas essas duas grandezas, em função de (p0 ,T0 ), como: