Questões de Concurso
Para engenharia química
Foram encontradas 2.418 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A cromatografia é um método físico-químico de separação, identificação e quantificação de componentes de uma mistura e seu uso é difundido em diversas áreas, inclusive na área forense. Tendo em vista que esse método pode ser executado de diferentes maneiras, julgue o seguinte item.
A cromatografia líquida com fase normal é aquela em que a
fase estacionária é mais polar do que a fase móvel, enquanto
que a cromatografia com fase reversa é aquela em que a fase
móvel é mais polar.
O estado físico da fase estacionária define as cromatografias gasosa, líquida e supercrítica.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
Quando um estado excitado singleto decai para o estado
fundamental, o rendimento quântico de emissão depende
apenas do somatório dos rendimentos quânticos de absorção e
emissão.
Tendo em vista que, do ponto de vista prático, a quimiometria permite planejar ou selecionar condições ótimas de medidas e experimentos e, com isso, extrair o máximo de informação de dados químicos, julgue o item seguinte, relativo a esse assunto e a aspectos a ele correlacionados.
A calibração multivariada por mínimos quadrados parciais para
análise discriminante, ou PLS, é um método supervisionado
que não exige o uso de amostras conhecidas para o seu
treinamento.
Tendo em vista que, do ponto de vista prático, a quimiometria permite planejar ou selecionar condições ótimas de medidas e experimentos e, com isso, extrair o máximo de informação de dados químicos, julgue o item seguinte, relativo a esse assunto e a aspectos a ele correlacionados.
A análise das componentes principais é um método de
decomposição de matrizes cujo resultado permite agrupar
amostras com características similares e discriminar amostras
com características distintas.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 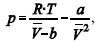 julgue o item que segue.
julgue o item que segue.
A partir do gráfico apresentado, conclui-se que o CO2 (g)
apresenta a constante b na equação de van der Waals inferior
à do O2 (g).

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 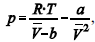 julgue o item que segue.
julgue o item que segue.
Quando atingida a pressão de 300 atm e a temperatura T2, o
volume ocupado pelo gás será menor do que aquele que seria
ocupado, nas mesmas condições, por um gás ideal.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 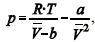 julgue o item que segue.
julgue o item que segue.
A uma pressão de 1,00 atm e temperatura de 300 K, o volume
ocupado pelo O2 (g) formado na decomposição de 4,00 mol de
H2O2 será superior a 46,0 L.
Considere as Cartas de Controle apresentadas a seguir:
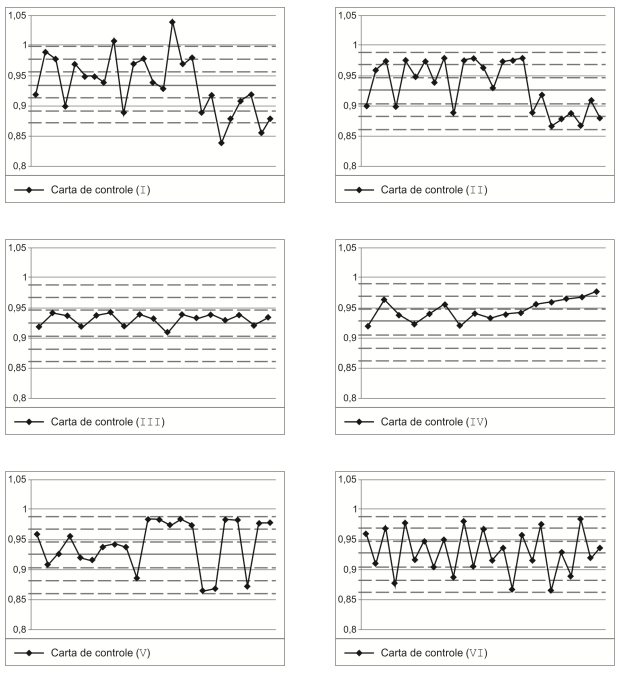
Analisando as Cartas de Controle é correto afirmar que:

Os limites de controle superior e inferior, respectivamente, LSC e LIC, são calculados a partir da média da variável X e de múltiplos do desvio padrão (k.σ), geralmente k = 3 ou em função da constante A (A.σ), que depende do tamanho das amostras. É também usual a utilização de limites de alerta para (X ± 1.σ) e (X ± 2.σ). É correto afirmar:
Algumas substâncias orgânicas são um desafio à depuração biológica, já que o nível de biodegradação é extremamente baixo ou nulo, e ainda muitas vezes acabam prejudicando a decomposição de outros poluentes associados.
Para romper as estruturas desses compostos orgânicos devem ser usados processos
Atenção: Utilize as Figuras 5 e 6 para responder à questão.
Para os cálculos adotar g = 10,0 m . s−2 e massa específica da água igual a 1.000 kg . m−3.

Atenção: Utilize as Figuras 5 e 6 para responder à questão.
Para os cálculos adotar g = 10,0 m . s−2 e massa específica da água igual a 1.000 kg . m−3.

Na instalação da Figura 5 deseja-se bombear água a 20 °C na vazão de 30 m3 . h−1. A perda de carga na tubulação na sucção (trecho 1 a 2) é de 10,0 J . kg−1. Já a perda de carga na tubulação no recalque (trecho 3 a 4) é de 3,0 m.c.a. Será utilizado a bomba KSB Megabloc modelo 32-125 com rotação de 3.500 rpm, no gráfico a altura manométrica (H) é dada em m.c.a., a vazão da água (Q) em m3 . h−1 e os diâmetros dos rotores em mm. Desprezar a variação de energia cinética.
O menor diâmetro do rotor que atenderá a instalação é de
A velocidade de sedimentação de uma partícula em fluxo laminar pode ser calculada pela lei de Stockes:
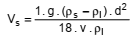
onde:
Vs = velocidade de sedimentação da partícula (m . s−1)
g = aceleração da gravidade (m . s−2)
v = viscosidade cinemática da água (m2 . s−1)
ρs = densidade da partícula (kg . m−3)
ρl = densidade do líquido (kg . m−3)
d = diâmetro da partícula (m)
A equação que representa a velocidade de sedimentação em um tubo de sedimentação é expressa por:
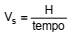
e a vazão de água no tanque da Figura 4 é expressa matematicamente por:

Sabendo também que em um tanque de fluxo horizontal a velocidade de sedimentação de uma partícula é composta por duas partículas como representadas na Figura 4:
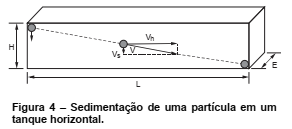
É correto afirmar que:
Atenção: Utilize as Figuras 1 e 2 e as equações abaixo para responder à questão.
