Questões de Concurso
Para engenharia química
Foram encontradas 2.513 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considerando que o trabalho em laboratório, muitas vezes, leva o operador à exposição a produtos químicos, foram estabelecidas algumas definições que permitem classificar o risco.
Nesse contexto, é incorreto afirmar:
Na representação de processos industriais, podem ser utilizados três tipos de fluxogramas: o diagrama de blocos, o diagrama de fluxo de processos (PFD) e o diagrama de instrumentação e tubulações (P&ID).
Considerando-se, apenas, os diagramas de fluxo de processos (PFD), é incorreto afirmar:
Na fabricação do queijo artesanal, após o processo de pasteurização, o leite é conduzido ao tanque de coagulação onde sofrerá alguns processos físicos e químicos. Devido ao alto teor de umidade, elevado valor de pH e grande manipulação durante a fabricação, o queijo torna-se extremamente suscetível aos fenômenos bioquímicos e microbiológicos que afetam as características de qualidade de rendimento e durabilidade. Por esse motivo é feita a fermentação lática do queijo, que é uma forma de melhorar as características de produção e de preservação, diminuindo as alterações qualitativas, ao longo do tempo de estocagem. O processo de fermentação lática ocorre segundo a equação química a seguir.
C6 H12O6 → 2CH3CHOHCOOH
Sobre o processo de fermentação lática, considere que um técnico fez as seguintes afirmações:
I. A fermentação lática é um processo que diminui a acidez do queijo.
II. A fermentação lática está relacionada com a transformação da lactose do leite.
III. O produto formado na fermentação lática contém os grupos funcionais álcool e ácido carboxílico.
Estão corretas as afirmações:
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
À radiação eletromagnética emitida por um corpo em
qualquer temperatura, constituindo uma forma de
transmissão de calor, ou seja, por meio deste tipo de
radiação ocorre transferência de energia térmica na
forma de ondas eletromagnéticas, é chamada de:
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
Vaporiza um líquido, recebendo calor normalmente de vapor d’água, ou de outro fluido quente disponível. Opera em conjunto com torres de processamento, vaporizando parte dos seus produtos de fundo.
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
São equipamentos em que dois fluidos com temperaturas diferentes trocam calor através de uma interface metálica. Esta troca térmica é empregada para atender às necessidades do processo e/ou economizar a energia que seria perdida para o ambiente. No processo de troca térmica pode haver ou não mudança de fase (condensação ou evaporação) dos fluidos envolvidos.
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
O equipamento que promove a troca de energia entre um sistema mecânico e um fluido, transformando energia mecânica em energia de fluido ou energia de fluido em energia mecânica. É denominado:
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
O processo de produção e utilização combinada de calor e eletricidade, proporcionando o aproveitamento de mais de 70% da energia térmica proveniente dos combustíveis utilizados nesse processo é conhecido como:
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
É o movimento ascendente ou descendente de matéria em um fluido:
Considerando o transporte de moléculas e de íons, através de uma membrana, analise as afirmativas abaixo:
I- Potenciais de difusão são formados quando íons de cargas opostas movimentam-se através de uma membrana com taxas diferentes.
II- A equação de Nernst relaciona o potencial de membrana à distribuição de um íon no equilíbrio.
III- O transporte de elétrons é um determinante importante do potencial da membrana.
IV- A parede celular representa uma barreira à permeabilidade da membrana plasmática.
Estão corretas apenas as afirmativas
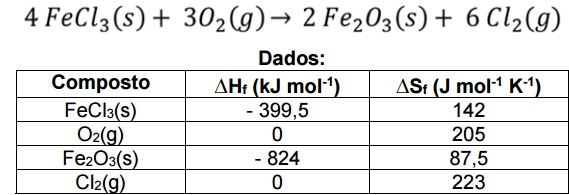
Para a equação química abaixo, ocorrendo a pressão constante e temperatura de 25 ºC, o valor de ∆G, em KJ, é aproximadamente
Em um processo reversível, a variação no sistema é feita de tal maneira que ele possa ser restaurado ao seu estado original exatamente pela reversão da variação. Um exemplo de processo reversível que ocorre a temperatura constante, no qual as fases estão em equilíbrio, é a água entrando em ebulição a 100º C. Qual a variação de entropia quando 1 mol de água for convertido em 1 mol de vapor a 1 atm de pressão?
Dado: ΔHvaporização (H2O) = +40,67 kJ mol-1
Embora a cromatografia gasosa e a cromatografia líquida tenham muitas características em comum, há diferenças em relação aos requisitos de amostra e de analito, seus formatos e o papel da fase móvel em ambas. A respeito das especificidades das cromatografias líquida e gasosa, analise as afirmativas abaixo.
I. Para compostos termicamente instáveis, a cromatografia gasosa é mais adequada.
II. Em cromatografa líquida, a retenção entre os analitos pode ser alterada mudando a fase móvel.
III. A retenção de um soluto em cromatografia líquida depende da interação dos componentes da amostra tanto com a fase móvel quanto com a estacionária.
Está correto o que se afirma em: