Questões de Concurso
Para engenharia química
Foram encontradas 2.418 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considerando-se que sejam válidas as leis de Raoult e de Dalton e que as pressões de vapor dos hidrocarbonetos a 44 oC sejam: n-butano = 420 kPa e n-pentano = 132 kPa, o percentual molar de n-butano na mistura líquida é
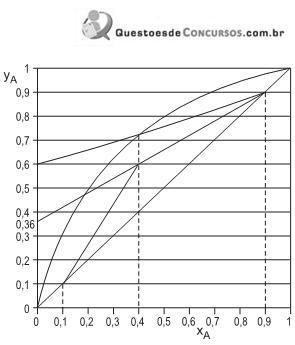
O gráfico
 versus
versus  , apresentado acima, mostra as retas de operação usadas na montagem do diagrama de McCabe-Thiele, além de alguns pontos característicos. Com base nos dados apresentados no diagrama, conclui-se que a
, apresentado acima, mostra as retas de operação usadas na montagem do diagrama de McCabe-Thiele, além de alguns pontos característicos. Com base nos dados apresentados no diagrama, conclui-se que a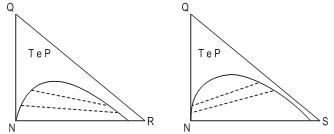
Os diagramas ternários acima representam o equilíbrio dos componentes N e Q com dois diferentes solventes, R e S. As linhas tracejadas correspondem às linhas de amarração (tie lines). Ao se comparar os diagramas apresentados e os dois solventes, conclui-se que o solvente R é
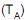 diminui, aumentando quando a temperatura da etapa isotérmica de rejeição de calor
diminui, aumentando quando a temperatura da etapa isotérmica de rejeição de calor 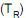 aumenta. Nesse contexto, a potência usada na compressão para a absorção de uma taxa de calor Q é representada pela seguinte expressão:
aumenta. Nesse contexto, a potência usada na compressão para a absorção de uma taxa de calor Q é representada pela seguinte expressão:

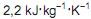 , e considerando-se a compressão como adiabática, o gás com comportamento ideal e as ineficiências associadas à máquina como nulas, a variação de temperatura entre a sucção e a descarga do compressor deve ser aproximadamente igual a
, e considerando-se a compressão como adiabática, o gás com comportamento ideal e as ineficiências associadas à máquina como nulas, a variação de temperatura entre a sucção e a descarga do compressor deve ser aproximadamente igual adh = Tds + vdp.
Usando uma das relações de Maxwell, a variação da entalpia com relação à pressão, mantendo-se a temperatura constante,
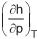 é determinada pela expressão
é determinada pela expressão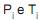 , é submetida a um processo de alteração de suas variáveis de estado até que estas atinjam novos valores
, é submetida a um processo de alteração de suas variáveis de estado até que estas atinjam novos valores 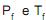 . Esse processo é baseado em duas etapas em sequência:
. Esse processo é baseado em duas etapas em sequência:1ª – Aquecimento à pressão constante até atingir a temperatura
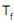 .
. 2ª – Compressão isotérmica do gás até atingir uma pressão
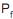 .
. Considerando-se que a capacidade calorífica à pressão constante
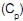 mantém o mesmo valor ao longo do processo, a variação da energia interna do sistema é igual a
mantém o mesmo valor ao longo do processo, a variação da energia interna do sistema é igual a
O balanço de massa global na coluna e os valores das
entalpias específicas das correntes da envoltória global
são dados na tabela a seguir.

A carga térmica removida pela água de resfriamento no
condensador é de 4,2 GJ/h.
 em proporções
em proporções estequiométricas e
 na razão de 0,4 mol para 100 mol
na razão de 0,4 mol para 100 mol de
 é carga fresca de um processo catalítico
é carga fresca de um processo catalítico para a produção de metanol, de acordo com a equação:
 .
.O efluente do reator passa por um processo de separação,
no qual todo o metanol e a água produzidos são separados
por condensação. Os gases contendo os reagentes não
reagidos e o
 são reciclados para o reator, misturando-
são reciclados para o reator, misturando--se com a carga fresca (F), dando origem à carga
combinada (CC). Para evitar acúmulo de
 no reator,
no reator, parte da corrente gasosa é purgada, conforme o esquema
abaixo. A conversão global dos reagentes é de 96%. A
vazão molar de
 na carga fresca é de 5 mol/s.
na carga fresca é de 5 mol/s.
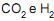 , é de 0,6, analise as afirmativas abaixo:
, é de 0,6, analise as afirmativas abaixo: I - A conversão de
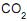 por passagem no reator é de 60%.
por passagem no reator é de 60%. II - A vazão molar de
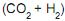 na carga combinada é 24 mol/s.
na carga combinada é 24 mol/s. III - A razão molar de
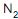 na corrente de carga combinada (CC) é de 0,10.
na corrente de carga combinada (CC) é de 0,10. Está correto o que se afirma em
 em proporções
em proporções estequiométricas e
 na razão de 0,4 mol para 100 mol
na razão de 0,4 mol para 100 mol de
 é carga fresca de um processo catalítico
é carga fresca de um processo catalítico para a produção de metanol, de acordo com a equação:
 .
.O efluente do reator passa por um processo de separação,
no qual todo o metanol e a água produzidos são separados
por condensação. Os gases contendo os reagentes não
reagidos e o
 são reciclados para o reator, misturando-
são reciclados para o reator, misturando--se com a carga fresca (F), dando origem à carga
combinada (CC). Para evitar acúmulo de
 no reator,
no reator, parte da corrente gasosa é purgada, conforme o esquema
abaixo. A conversão global dos reagentes é de 96%. A
vazão molar de
 na carga fresca é de 5 mol/s.
na carga fresca é de 5 mol/s.
I - A vazão molar de metanol produzido é de 4,8 mol/s.
II - A fração molar de metanol na corrente de produto D é de 0,50.
III - A razão molar
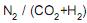 na corrente de purga P é de 0,10.
na corrente de purga P é de 0,10. Está correto o que se afirma em
I - A primeira lei da termodinâmica estabelece que a variação de energia interna em um sistema é igual à diferença entre o calor e o trabalho no eixo realizado.
II - Em um ciclo termodinâmico para transformação de calor em trabalho, o calor absorvido e o trabalho realizado são grandezas numericamente iguais, obedecendo dessa forma, ao princípio da conservação da energia.
III - De acordo com a segunda lei da termodinâmica, é inviável a realização de um ciclo termodinâmico capaz de transferir calor de um ambiente a baixa temperatura para um ambiente a uma temperatura mais elevada.
IV - A entropia é uma função de estado cuja variação diferencial pode ser caracterizada por meio da razão entre o calor trocado e a temperatura, ao longo de uma trajetória reversível.
V - A segunda lei da termodinâmica impõe que, em um sistema isolado, as variações de entropia serão sempre positivas ou nulas.
São corretas APENAS as afirmativas
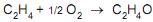
No entanto, em paralelo ocorre a reação indesejável de combustão do eteno
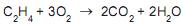
A conversão global de eteno no processo é de 95,0%, e a seletividade do etilenoglicol em relação ao
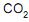 é de 18,5:1.
é de 18,5:1. De acordo com os dados fornecidos, o rendimento do óxido de etileno no processo é de