Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.288 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
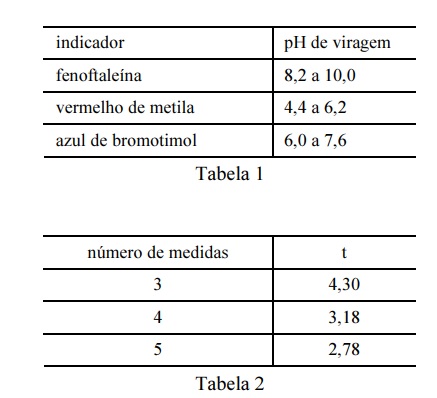
Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%.
Com base nessas informações, julgue os itens seguintes.
Considerando-se a inexistência de erros sistemáticos, é correto afirmar que a probabilidade de que o valor real da concentração de NaOH esteja no intervalo compreendido entre 0,078 e 0,082 será maior que 95%.
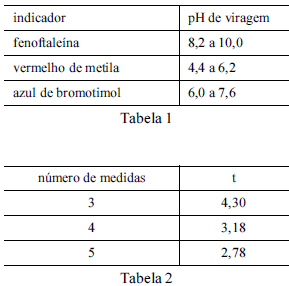
Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%. Com base nessas informações, julgue os itens seguintes.
A partir dos resultados obtidos, pode-se inferir que o volume
médio da solução de NaOH gasto na titulação é maior que
22,0 mL.
Preparou-se 100 mL de uma solução padrão de biftalato de potássio, de acordo com o seguinte procedimento: (i) pesagem de um béquer vazio em uma balança analítica; (ii) pesagem do béquer contendo 2,0000 g do biftalato na mesma balança; (iii) dissolução do biftalato, por meio da adição de água suficiente ao béquer; (iv) transferência de todo o conteúdo do béquer para um balão volumétrico de 100,00 mL; (v) preenchimento do balão com água até o menisco.
Considerando as informações acima e que os desvios padrão sejam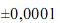 g, para uma simples leitura na balança utilizada, e
g, para uma simples leitura na balança utilizada, e 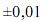 mL, para uma leitura de menisco no balão, julgue o próximo item.
mL, para uma leitura de menisco no balão, julgue o próximo item.
O desvio padrão relativo para a concentração da solução de biftalato de potássio preparada é maior que 1,0×10-4 .
Considerando as informações acima e que os desvios padrão sejam
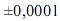 g, para uma simples leitura na balança utilizada,
g, para uma simples leitura na balança utilizada,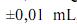 e , para uma leitura de menisco no balão, julgue os próximos itens.
e , para uma leitura de menisco no balão, julgue os próximos itens.Caso a solução de biftalato preparada seja usada, posteriormente, na padronização de uma solução básica, a presença de impurezas no biftalato usado para a preparação de sua solução gerará um erro aleatório que, consequentemente, afetará a precisão dos resultados obtidos durante a padronização.
água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.
água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.
Os fenóis e seus derivados aparecem nas águas naturais por meio das descargas de efluentes industriais. Indústrias de processamento da borracha, colas e adesivos, resinas impregnantes, componentes elétricos (plásticos) e as siderúrgicas, entre outras, são responsáveis pela presença de fenóis nas águas naturais. Os fenóis constituem-se em padrão de potabilidade, sendo imposto o limite máximo bastante restritivo de 0,001mg/L.
Internet: www.cetesb.sp.gov.br. Acesso em 29/1/2010 (com adaptações).
O fenol pode ser quantificado por espectrofotometria de absorção. O comprimento de onda indicado para a realização da medida de absorção de fenol é 293nm. Acerca desse método, julgue os itens abaixo como Verdadeiros (V) ou Falsos (F) e, em seguida, assinale a opção correta.
I – A espectrofotometria descrita utiliza radiação eletromagnética da região do visível.
II – Quanto maior a concentração de fenol, maior será a intensidade da luz transmitida.
III – O coeficiente de absorção molar do fenol, que é um parâmetro necessário para a determinação da concentração de fenol na amostra, depende do comprimento de onda da luz incidente, da temperatura e do solvente.
A sequência correta é:
Nessa situação hipotética, para preparar 1,5 mL de uma solução diluída a 10 μg/L diretamente a partir da solução-padrão estoque, é necessário tomar
10 μL da solução concentrada.
Acerca das características de qualidade da água, julgue o item subsequente.
Em contato com a água, materiais sólidos podem se dissolver
ou permanecer sólidos em suspensão ou no estado coloidal. No
estado coloidal, encontram-se algas, vírus, bactérias, matéria
orgânica e corantes vegetais, mas não argilas, siltes, areias e
sílicas, que só são encontradas em suspensão.
Julgue o item subsequente, acerca da diluição de compostos utilizados na limpeza de vidrarias de laboratório.
Para o preparo de uma solução de detergente a partir de
concentrado em pó, cuja instrução de preparo seja a diluição
para 20% p/v, deve-se adicionar 20 mL do pó e 80 mL de
água.
Julgue o item subsequente, acerca da diluição de compostos utilizados na limpeza de vidrarias de laboratório.
Um frasco que contenha 10 mL de detergente na concentração
de 0,5 mol/L deve ter todo seu volume acrescentado a 10 mL
de água, caso a concentração de uso seja 0,25 mol/L.
Um frasco que contenha solução estoque concentrada de detergente identificada como 10X deve ter 1 mL de seu conteúdo diluído em 9 mL de água antes do uso.
Considerando que, nas soluções de produtos químicos, a concentração e o título são medidos pela relação entre as quantidades de soluto e de solução, julgue o item que se segue.
Em um litro de solução de KOH (massa molar igual 56 g/mol)
e concentração 0,2 molar estão contidos 5,6 g de soluto.
Considerando que, nas soluções de produtos químicos, a concentração e o título são medidos pela relação entre as quantidades de soluto e de solução, julgue o item que se segue.
Se, no rótulo de um vidro contendo 0,5 L de sulfato de níquel,
estiver indicada uma concentração de 50 g/L, então, em 2,0 L
dessa solução, a concentração será de 12,5 g/L.
Considerando que, nas soluções de produtos químicos, a concentração e o título são medidos pela relação entre as quantidades de soluto e de solução, julgue o item que se segue.
Pelo padrão internacional, a água potável não pode conter mais
do que 5,0 × 10-4
mg de mercúrio por grama de água, ou seja,
uma concentração de 0,5 ppm.
Considerando que, nas soluções de produtos químicos, a concentração e o título são medidos pela relação entre as quantidades de soluto e de solução, julgue o item que se segue.
Em uma solução de álcool gel de limpeza com título 48%, a
quantidade de etanol presente é igual a 48 mL/L de solução.
Considerando que, nas soluções de produtos químicos, a concentração e o título são medidos pela relação entre as quantidades de soluto e de solução, julgue o item que se segue.
Em 1,0 L de solução aquosa, a concentração comum de 10 g de
cloreto de sódio é maior que 0,1 g/mL.