Questões de Vestibular
Sobre calor latente em física
Foram encontradas 49 questões
Dentro de um calorímetro perfeito, de capacidade C = 40 cal/°C e temperatura inicial 0 °C, colocam-se 100 g de um material de calor específico 0,50 cal/g°C a uma temperatura de 90 °C, e uma massa de 10 g de gelo a 0 °C. Calcule, em °C, o valor da temperatura final de equilíbrio do sistema.
Dados:
CÁGUA = 1,0 cal/g°C
LFUSAO GELO = 80 cal/g
Um calorímetro de capacidade térmica igual a 80 cal/°C está a uma temperatura de 40°C. Ao misturar, dentro desse calorímetro, uma massa de gelo M a 0°C e 70 g de água a 80°C, a temperatura de equilíbrio é 50°C.
Calcule a massa de gelo M em gramas.
Dados
cágua= 1,0 cal/(g.°C)
Lfusão= 80 cal/g.
Um sistema de esterilização de material cirúrgico utiliza um subsistema de produção de vapor d'água. O vapor é obtido a partir do calor fornecido à água líquida, gerado por uma resistência elétrica. A ddp usada pelo equipamento é de 120 V, e sua resistência elétrica é de 2,40 Ω. Supondo, inicialmente, que a água líquida encontra-se a 100 °C, calcule quanto tempo é necessário para que este sistema de vaporização produza um quilograma de vapor à temperatura de 100 °C. Suponha que todo o calor produzido pela resistência elétrica é absorvido pela água. Dado: calor latente de vaporização da água L = 2250 kJ/kg, onde 1 kJ = 103 J.
Para obter energia térmica, com a finalidade de fundir determinada massa de gelo, produziu-se a combustão de um mol de gás butano (C4H10), a 1 atm e a 25 ºC. A reação de combustão desse gás é:
C4H10 (g) +13/2 O2 (g)→ 4CO2 (g) + 5H2 O (l)
As entalpias-padrão de formação (ΔH) das substâncias citadas estão indicadas na tabela:
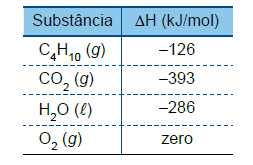
Considerando que a energia térmica proveniente dessa reação foi integralmente absorvida por um grande bloco de gelo
a 0 ºC e adotando 320 J/g para o calor latente de fusão do
gelo, a massa de água líquida obtida a 0 ºC, nesse processo,
pelo derretimento do gelo foi de, aproximadamente,
Uma massa de água no estado sólido, inicialmente à temperatura de –10 ºC, é aquecida até atingir a temperatura final de 80 ºC. Considere que todo o processo tenha ocorrido à pressão constante de 1,0 atm e que essa massa de água tenha recebido um total de 16500 cal para o processo térmico. Sem levar em conta os efeitos de sublimação do gelo para temperaturas abaixo de 0 ºC, assuma que o valor para o calor específico do gelo seja de 0,5 cal/g ºC, que o calor específico da água seja 1,0 cal/g ºC e que o calor latente de fusão do gelo seja de 80,0 cal/g.
Nesse caso, a massa de água aquecida, em gramas, durante o processo é de

Dados
cágua = 1,0 cal/(gº C)
Lfusão = 80 cal/g
Considere os seguintes dados: Calor específico do gelo = 0,5 cal/g.°C
Calor específico da água = 1,0 cal/g.°C
Calor latente de fusão do gelo = 80 cal/g
De acordo com os dados acima, as massa M1 e M2 valem
Note e adote:
calor latente de fusão do gelo = 80 cal/g;
calor específico do gelo = 0,5 cal/g °C;
calor específico da água = 1,0 cal/g °C.
Uma quantidade de calor Q = 56.100,0 J é fornecida a 100 g de gelo que se encontra inicialmente a -10 °C.
Sendo
o calor específico do gelo cg = 2,1 J/(g°C),
o calor específico da água ca = 4,2 J/(g°C) e
o calor latente de fusão CL = 330,0 J/g,
a temperatura final da água em °C é,
aproximadamente,
π= 3. Calor latente de vaporização da água: 2 x 106 J/kg. Densidade da água: 103 kg/m3. 1 dia = 8,6 x 104 s.