Questões de Vestibular
Comentadas sobre teoria quântica em física
Foram encontradas 7 questões
Durante um experimento, um professor demonstrou o efeito fotoelétrico iluminando diferentes placas metálicas com radiação infravermelha (E = 1,38 eV) e radiação ultravioleta (E = 4,13 eV).
A tabela a seguir apresenta a função trabalho (f) dos materiais utilizados.
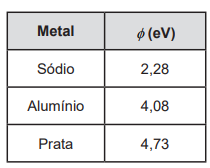
Como resultado, quando as placas foram iluminadas com radiação infravermelha, o fenômeno _________ observado nesses materiais. Quando as placas foram iluminadas com radiação ultravioleta, o fenômeno não foi observado para _________, enquanto a máxima energia cinética dos fotoelétrons foi observada para _________.
A figura a seguir representa a emissão fotoelétrica em uma placa de césio com função trabalho de 2,14 eV, iluminada pela radiação violeta, com comprimento de onda igual a 400 nm. hƒ é a energia dos fótons; EC é a energia cinética máxima dos elétrons emitidos e W é a função trabalho do material de que é feito o alvo, ou seja, a energia mínima que um elétron deve adquirir para poder escapar do material.
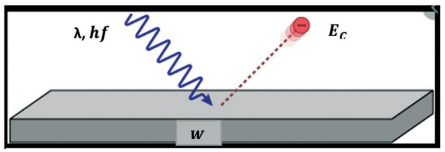 A figura está sem escala, uso de cores fantasia.
A figura está sem escala, uso de cores fantasia. Considerando a constante de Planck 4,2.10-15 eVs e a velocidade da luz no vácuo de 3,0.108 m/s, a energia cinética, em eV do elétron ejetado, é igual a
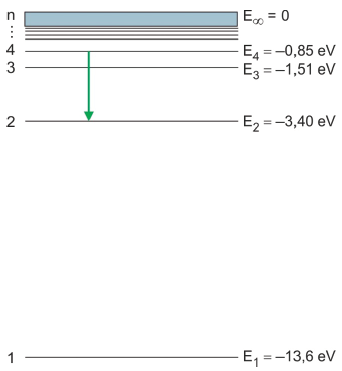 (http://astro.if.ufrgs.br. Adaptado.)
(http://astro.if.ufrgs.br. Adaptado.)A quantidade de energia associada ao fóton emitido pelo átomo de hidrogênio na transição mostrada na figura é
Entre os resíduos radioativos mais poluentes provenientes do desastre, estão os isótopos, com a respectiva meia-vida entre parênteses: Xenônio-133 (133Xe - 5,2 dias), Iodo-131 (131I - 8 dias), Césio-134 (134 Ce - 2 anos), Estrôncio-90 (90Sr - 28,8 anos) e Césio-137 (137Ce - 32,2 anos). Atualmente, e por vários anos a seguir, o 90Sr e o 137Ce são as principais fontes de radiação na região afetada pela explosão.
A figura abaixo mostra, em particular, a cadeia de decaimentos que leva o 137Ce ao isótopo estável Bário-137 (137Ba).
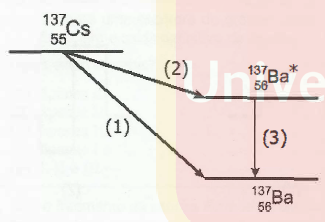
Os processos indicados pelas setas (1), (2) e (3) são, respectivamente, decaimentos
DADOS QUE PODEM SER USADOS NESTA PROVA
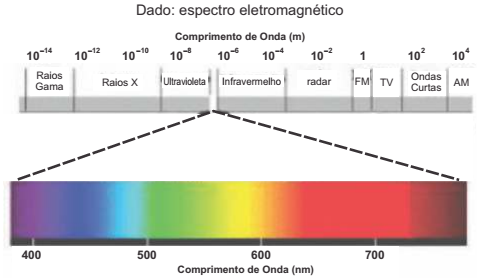
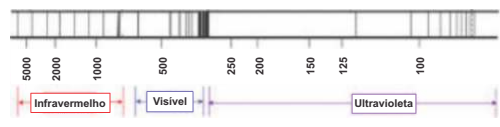
O espectro de emissão do hidrogênio apresenta uma série de linhas na região do ultravioleta, do visível e no infravermelho próximo, como ilustra a figura a seguir.
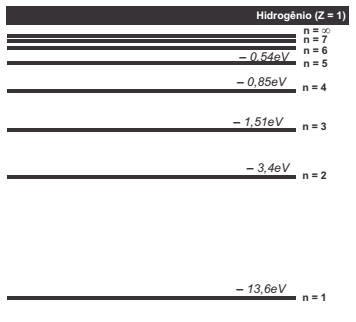
Niels Bohr, físico dinamarquês, sugeriu que o espectro de emissão do hidrogênio está relacionado às transições do elétron em determinadas camadas. Bohr calculou a energia das camadas da eletrosfera do átomo de hidrogênio, representadas no diagrama de energia a seguir. Além disso, associou as transições eletrônicas entre a camada dois e as camadas de maior energia às quatro linhas observadas na região do visível do espectro do hidrogênio.
Um aluno encontrou um resumo sobre o modelo atômico elaborado por Bohr e o espectro de emissão atômico do hidrogênio contendo algumas afirmações.
I. A emissão de um fóton de luz decorre da transição de um elétron de uma camada de maior energia para uma camada de menor energia.
II. As transições das camadas 2, 3, 4, 5 e 6 para a camada 1 correspondem às transições de maior energia e se encontram na região do infravermelho do espectro.
III. Se a transição 3→ 2 corresponde a uma emissão de cor vermelha, a transição 4→ 2 está associada a uma emissão violeta e a 5→ 2 está associada a uma emissão verde.
Pode-se afirmar que está(ão) correta(s)