Questões de Vestibular
Sobre cadeias carbônicas: características e classificações do átomo do carbono, tipos de ligação e hibridação. tipos de cadeias carbônicas e fórmulas. séries: homóloga, isóloga e heteróloga. em química
Foram encontradas 403 questões
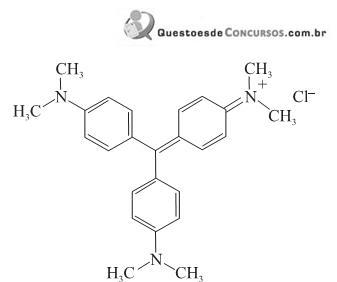
Em relação à violeta genciana, afirma- se:
I. Apresenta grupos funcionais amina e radicais metila
II. Apresenta carbono quiral.
III. Forma ligação de hidrogênio intermolecular.
É correto apenas o que se afirma em
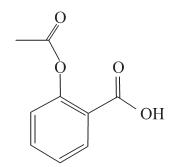
Na hidrólise da aspirina é formada uma substância que está presente no vinagre e também o ácido salicílico, que tem fórmula molecular