Questões de Vestibular
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 77 questões
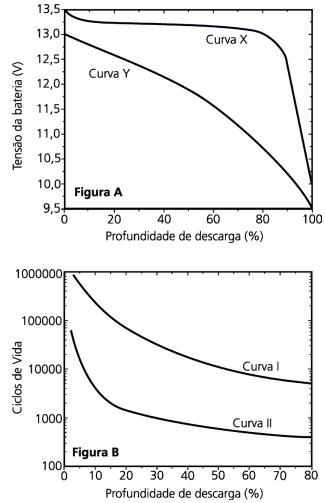
Levando em conta essas informações, seria apropriado escolher para equipar um carro
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

As baterias recarregáveis possuem a característica de prolongar muito sua vida útil, o que aumenta a relação custo-benefício. A bateria recarregável mais conhecida é a bateria de chumbo usada nos carros, que, por armazenar energia elétrica, é definida como bateria de armazenamento. Esse tipo de bateria consiste em seis células, cada uma gerando 2,0 V para um total de 12,0 V. A reação celular geral é dada pela seguinte equação química:
Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
Sobre essa reação, é correto afirmar que
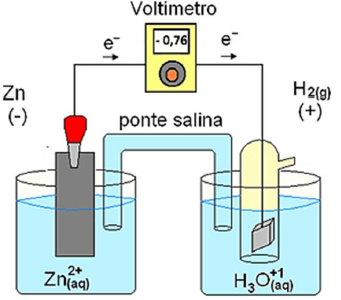
Fonte: https://mundoeducacao.uol.com.br/quimica/potencialpadrao-reducao-das-pilhas.htm. Acesso 15/05/2021.
Em relação a essa pilha, foram feitas as seguintes afirmativas:
I – Durante o funcionamento da pilha, a acidez da solução no catodo diminui. II – Ocorre oxidação da espécie Zn2+(aq). III – A semirreação de redução que ocorre na pilha é: 2H+(aq) + 2e- ➜ H2(g). IV – A força eletromotriz da pilha é dependente da concentração das espécies em solução.
Estão CORRETAS as afirmativas:
No fragmento a seguir, o autor explora conceitos químicos na forma de poesia:
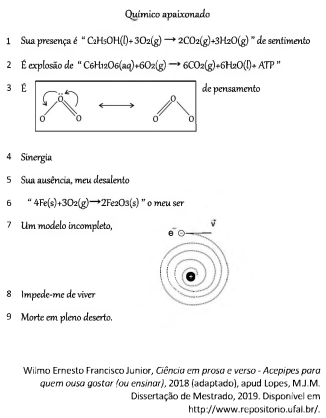
Sobre os conceitos mencionados, foram feitas as seguintes afirmações:
I. A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de fotossíntese com consumo de gás carbônico.
II. A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada a corrosão.
III. O modelo incompleto referido na linha 7 refere-se ao proposto por Thomson, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Está correto o que se afirma no(s) item(ns):
Assinale a alternativa que apresenta o tempo aproximado que a célula de eletrodeposição deve ser mantida ligada, nas condições apresentadas, para que a propaganda seja verdadeira.
Dados: Massa atômica do ouro = 197 u. Constante de Faraday = 96500 C/mol de e-
Cu2+(aq) + 2e- → Cu(s) Eº = +0,34 V Fe2+ (aq) + 2e- → Fe(s) Eº = -0,44 V Zn2+(aq) + 2e- → Zn(s) Eº = -0,76 V Al3+ (aq) + 3e- → Al(s) Eº = -1,66 V
Considerando os potenciais padrão de redução apresentados, avalie as sentenças abaixo e assinale aquela quimicamente INCORRETA quanto ao processo de corrosão.
A tradição de produzir joias e semi joias em Juazeiro do Norte vem desde os tempos do Padre Cícero. Como a cidade recebia muitos visitantes para casar e não tinham alianças, surgiam daí as primeiras oficinas de joias. A galvanoplastia utiliza a eletrolise em meio aquoso para cobrir uma determinada peça metálica com outro metal. Na prateação (Ag + ) de uma aliança, fez-se passar pelas células uma corrente de 3,72 ampères durante 20 minutos. Qual a massa de prata, depositada na superfície da aliança. Dados Ag = 108
Analise as reações.
Reação 1 – Obtenção de água sanitária
Cℓ2 (g) + 2NaOH (aq) → NaCℓ O (aq) + NaCℓ (aq) + H2O (ℓ)
Reação 2 – Reação de carga de uma bateria chumbo/ácido
2PbSO4 (s) + 2H2O (ℓ) → Pb (s) + PbO2 (s) + 2H2SO4 (aq)
Reação 3 – Combustão de magnésio metálico
Mg (s) + 1/2 O2 (g) → MgO (s)
Reação 4 – Obtenção de cal
CaCO3 (s) → CaO (s) + CO2 (g)
São exemplos de oxirredução, que apresentam um reagente atuando simultaneamente como oxidante e redutor, as
reações
O esquema apresenta uma célula a combustível de ureia, as semirreações e seus potenciaispadrão de redução.
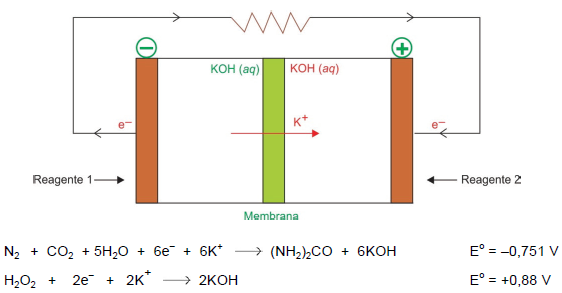
(Ke Ye et al. “Recent Advances in the electro-oxidation of urea for direct urea fuel cell and urea electrolysis”. Topics in Current Chemistry, 2018. Adaptado.)
O potencial-padrão dessa célula a combustível e todos os produtos da reação global são, respectivamente,
Semirreação Eu (V) Al3+ (aq) + 3 e- ⇌ A I (s) -1,66 Zn2+ (aq) + 2 e- ⇌ Zn (s) -0,76 Fe2+ (aq) + 2 e- ⇌ Fe (s) -0,44 Cu2+ (aq) + 2 e- ⇌ Cu (s) +0,34 Ag+ (aq) + e- ⇌ A g (s) +0,80
Com base na tabela, a afirmativa correta em relação ao processo de corrosão de metais é:
Após o balanceamento da equação iônica, com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Admitindo-se que os potenciais-padrão de redução, E° , do cobre e do cádmio, são, respectivamente, +0,337V e -0,403V, em relação a essa pilha, pode-se afirmar:
Um dos tipos de pilha mais eficientes são as de lítio. A reação redox que ocorre nessas pilhas é, simplificadamente, representada a seguir:
2 Li (s) + I2 (s) → 2 Li+ (aq) + 2 I−(aq)
Dados:
Eo Li+/Li = −3,05 V
Eo I2 /I− = +0,53 V
Quando o ferro ou o aço, já com camada de Fe2O3 , sofre corrosão em presença de umidade, têm-se as reações abaixo, em que Fe3O4 é de fato FeO·Fe2O3
Reação I: Fe → Fe2++ 2e
Reação II: 4 Fe2O3 + Fe2++ 2e → 3 Fe3O4
Nesse processo corrosivo,
(https://mycourses.aalto.fi. Adaptado.)
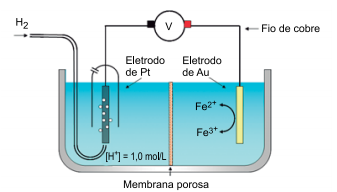
Considere os eletrodos de platina e de ouro inertes e os potenciais de redução das espécies químicas presentes nas soluções:

Durante o funcionamento da célula galvânica representada na figura,
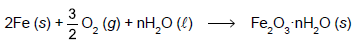
A tabela fornece os potenciais-padrão de redução (Eº) de algumas semirreações, a 25 ºC.

Com base nas informações fornecidas, pode-se afirmar que:

