Questões de Vestibular
Comentadas sobre equilíbrio químico em química
Foram encontradas 133 questões
Em um experimento realizado por Thomas Graham, dois gases A e B foram liberados simultaneamente nas extremidades de um tubo de vidro; esses gases difundiram-se em direção ao centro do tubo e, no instante em que se encontraram, formaram um anel de um composto AB, como mostra a figura a seguir.
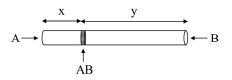
Para esses gases A e B, de massas molares MA e MB, respectivamente, verifica-se o seguinte postulado de Graham, em que vB representa a velocidade de difusão de B e vA, a velocidade de difusão de A.
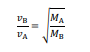
Tendo como referência essas informações e considerando que MA = 4MB, julgue o item.
Considere que o gás cloreto de hidrogênio (HCl) possa
ser obtido a partir dos gases hidrogênio (H2) e cloro (Cl2)
por meio da reação reversível H2(g) + Cl2(g) ⇌ 2 HCl(g) e que
um frasco fechado, a uma dada temperatura, contenha
esses três gases em equilíbrio, com 20% de H2 e 60% de
Cl2 em volume, a uma pressão total de 10 atm. Nessas
condições, a constante de equilíbrio, no que se refere à
pressão, é superior a 0,25.
Com base no texto anterior e nas informações precedentes e considerando que 1 L = 1 dm3 , julgue o item.
Em solução aquosa, o ácido cítrico sofre três reações de dissociação ácida, cujas equações químicas estão corretamente expressas a seguir.
C6H8O7(aq) + H2O(l) ⇌ C6H7O7 − (aq) + H3O+ (aq)
C6H7O7 − (aq) + H2O(l) ⇌ C6H6O7 2−(aq) + H3O+ (aq)
C6H6O7
2−(aq) + H2O(l) ⇌ C6H5O7
3−(aq) + H3O+
(aq)
N2 O4 (g) ⇌ 2 NO2 (g)
A partir de um experimento, foram registradas as variações das concentrações desses óxidos em função do tempo. Observe o gráfico:
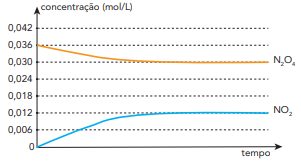
Com base nos dados obtidos, o valor da constante de equilíbrio em função das concentrações é igual a:
DADOS QUE PODEM SER USADOS NESTA PROVA

O pH de uma solução que contém um precipitado de Cr(OH)3 (Kps = 6.0 x 10-11 a uma dada temperatura) deve ser ajustado de modo que todo o precipitado se dissolva, produzindo uma solução na qual a [Cr3+] seja 0.1 mol/L.
Nesse caso, o valor do pH é de, aproximadamente:
Dado: Kw = 1.0x 10-14
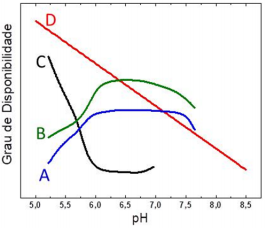
O hidróxido de alumínio (Al(OH)3), ao precipitar em solução aquosa, forma um sólido gelatinoso que pode ser usado como agente floculante no tratamento de água. Essa precipitação pode ocorrer pela adição de um hidróxido solúvel a uma solução aquosa ácida contendo um sal de alumínio solúvel, como o AlCl3. Entretanto, adicionando-se excesso de hidróxido ao meio, há a formação de íons Al(OH)4− , espécie solúvel em água, e o precipitado se solubiliza novamente. Dessa forma, dependendo do pH do meio, uma dentre as espécies Al(OH)4 −(aq), Al(OH)3(s) e Al 3+(aq) estará presente na solução em quantidade maior que as demais, como exemplificado no esquema.
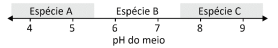
A alternativa que mostra corretamente qual das espécies estará
em quantidade maior que as duas outras em cada faixa de pH é:
Cálculos renais, conhecidos popularmente por “pedras nos rins”, consistem principalmente em oxalato de cálcio, CaC2O4, espécie cuja constante de solubilidade (Kps) é de aproximadamente 2 × 10−9 . Os íons oxalato, presentes em muitos vegetais, reagem com os íons cálcio para formar oxalato de cálcio, que pode gradualmente se acumular nos rins. Supondo que a concentração de íons cálcio no plasma sanguíneo seja de cerca de 5 × 10−3 mol/L, qual seria a concentração mínima, em mol/L, de íons oxalato para que CaC2O4 precipitasse?
Note e adote:
Desconsidere a presença de quaisquer
outros íons e considere que a
concentração no plasma é determinante
para a precipitação do oxalato.
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

N2(g) + 3H2(g) ⇌ 2NH3(g) ∆H° = -92,6 KJ.mol-1
Um aluno, analisando a equação fornecida, fez as seguintes afirmações:
I - É possível maximizar a produção de amoníaco se a reação ocorrer a pressões elevadas. II - Dada a natureza exotérmica da reação direta, quanto menor a temperatura do vaso reacional, maior será a produção de amoníaco.
A alternativa CORRETA é:
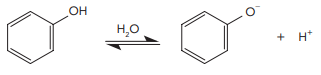
Considere um processamento no qual houve a dissolução completa de 0,01 mol de fenol em água para formar 1 L de solução a 20 °C. Nessa temperatura, a constante de acidez do fenol é igual a 10−10. Atingido o equilíbrio químico da ionização, a concentração de ânion fenolato, em mol/L, na solução, é aproximadamente igual a:
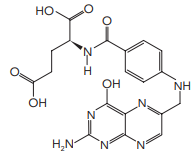
Considere um dado valor de pH, para o qual apenas os hidrogênios das carboxilas do ácido fólico se ionizam. Nessa situação, a carga do ânion formado é igual a:
Considerando essas informações e os conhecimentos de química, é correto afirmar que a calagem atua em solos
Para estudar equilíbrio químico de íons Co2+ em solução, uma turma de estudantes realizou uma série de experimentos explorando a seguinte reação:
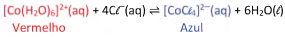
Nesse equilíbrio, o composto de cobalto com água, [Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o composto com cloretos, [CoCl4]2-(aq), possui coloração azul.
Para verificar o efeito de ânions de diferentes sais nessa mudança de cor, 7 ensaios diferentes foram realizados. Aos tubos contendo apenas alguns mL de uma solução de nitrato de cobalto II, de coloração vermelha, foram adicionadas pequenas quantidades de diferentes sais em cada tubo, como apresentado na tabela, com exceção do ensaio 1, no qual nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um tempo, e a cor final foi observada.
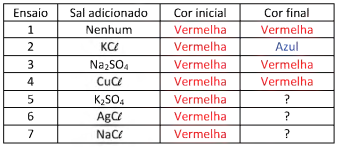
A alternativa que representa a cor final observada nos ensaios 5, 6 e 7, respectivamente, é:
Note e adote:
Solubilidade dos sais em g/100 mL de água a 20 °C
AgCℓ 1,9 x 10-4 NaCℓ 35,9
CuCℓ 9,9 x 10-3 Na2SO4 13,9
KCℓ 34,2 K2SO4 11,1


Um aluno do curso de química em uma aula prática de Química Geral, precisa preparar uma solução de hidróxido de potássio de pH = 12 a 25ºC. qual a massa de KOH que ele precisa dissolver em 200 mL de água para obter o pH desejado?
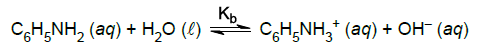
Sabe-se que Kb ≈ 4 × 10–10 a 25 ºC e que o valor de pH de uma solução aquosa saturada de anilina a 25 ºC é próximo de 9. Com base nessas informações e sabendo que Kw nessa temperatura é igual a 1 × 10–14, a concentração aproximada da solução saturada de anilina a 25 ºC é
Uma amostra de água mineral natural a 25 °C foi testada com três indicadores ácido-base. Os resultados desse teste estão indicados na última coluna da tabela.

Analisando as informações da tabela e sabendo que o
produto iônico da água a 25 °C, Kw, é igual a 1 × 10−14, a
concentração de íons OH− (aq) nessa água mineral, em
mol/L, está entre
