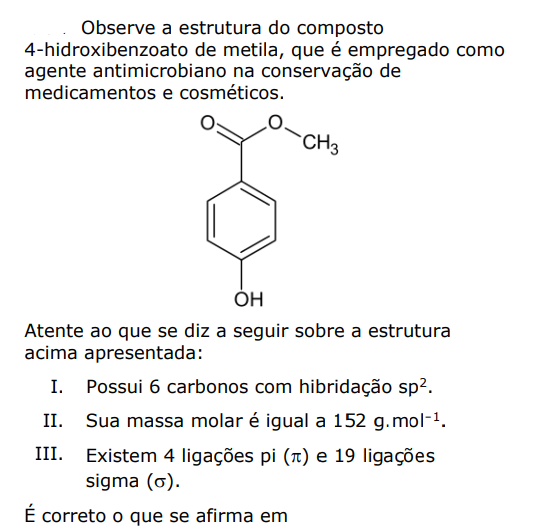
Questões de Vestibular
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 151 questões
Dado: massa molar do HCl = 36,5 g/mol.
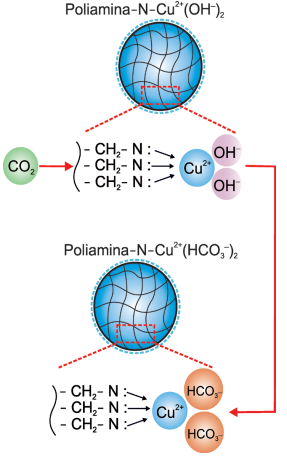
De acordo com os autores do estudo, 1 kg de poliamina contendo cobre é capaz de adsorver até 5 mols de CO2 , uma quantidade bem superior ao que se conhece até então. Com base nessas informações, pode-se concluir que a porcentagem em massa de cobre no sólido é cerca de
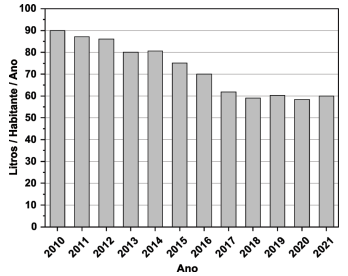
Dados:
i) ingestão total de energia diária para adultos: 8400 kJ (recomendação da OMS).
ii) energia por grama de açúcar: 16,5 kJ.
De acordo com as informações do gráfico e do texto 1, pode-se afirmar que a média de consumo diário de açúcar, por habitante, para cada ano, devido somente à ingestão de refrigerante,
CH4(g) + 3 Cl2(g) → CHCl3(l) + 3 HCl(g)
A quantidade de cloro, em gramas, necessária para produzir 1,5 mol de clorofórmio é
Considerando-se que, no processo de queima da argila, o hidróxido de cálcio se transforme em óxido de cálcio por desidratação, é correto afirmar que a queima de 100 g de hidróxido de cálcio produz menos de 50 g de CaO.
Bicarbonato de sódio é utilizado como medicamento antiácido. Em presença de ácido, esse composto reage de acordo com a equação química a seguir:
NaHCO3 + H+ → Na+ + CO2 + H2O
Na reação completa de 16,8 g de NaHCO3 , a massa, em gramas, de CO2 produzida é igual a:
Uma amostra de uma rocha de massa 0.250 g, com baixo teor de Cr, foi submetida à fusão com Na2O2 transformando o cromo em cromato (CrO4 = ). A amostra foi dissolvida em água em ebulição, acidificada e o CrO4 = foi convertido a dicromato (Cr2O7 = ). Na sequência, a amostra foi titulada com 27 mL de solução de Fe2+. Os produtos desta reação foram Fe3+ e Cr3+. Numa padronização paralela, 47 mL de Fe2+ foram usados na redução de 0.1172 g de K2Cr2O7. A reação decorrente foi:
Cr2O7 = + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O.
A massa percentual de Cr na amostra é:
O volume em mL (cm3 ) de uma solução de HNO3 de densidade 1.497 g/cm3 , contendo 93.25% por peso de HNO3 puro, necessários para atacar, completamente, uma esfera de cobre com 2.0 cm de diâmetro, é:
Dados: Volume da esfera: V = (4/3)πR3 , π = 3.14, densidade (Cu) = 8.9 g/cm3
Reação que ocorre: Cu + 4HNO3(conc.) → Cu(NO3)2 + 2H2O + 2NO2
DADOS QUE PODEM SER USADOS NESTA PROVA

A reação abaixo representa a decomposição deum carbonato onde X é um metal.
XCO3(s) → XO(s) + CO2(g)
Quando utilizamos 1,70 g de XCO3, são produzidos0,88 g de XO. Com base nesta informação e usando cálculos aproximados, é correto dizer que o metal é
Fe2O3(s) + 3 H2S(g) → Fe2S3(s) + 3 H2O(l)
A partir desses dados, pode-se afirmar que, na condição de remoção máxima de sulfeto de hidrogênio relatada no estudo,
Massas molares (g mol-1): Fe = 56, H = 1, O = 16 e S = 32.
Dados: 1.000 gramas de etanol combustível apresentam 940 g de etanol e 60 g de água; massas molares (g mol-1): C2H6O = 46; CO2 = 44.
Dados: Volume Molar (CATP) = 25 L; d(C8H18) = 800 g/L; Massas Molares – H = 1 g/mol; C = 12 g/mol; O = 16 g/mol
Al + Fe2O3 → Fe + Al2O3
Dados: Massas Molares – O = 16 g/mol; Al = 27 g/mol; Fe = 56 g/mol

Segundo o site saúde.gov.br, diabetes é uma doença causada pela produção insuficiente ou má absorção de insulina, hormônio que regula a glicose no sangue e garante energia para o organismo. Para evitar que as células parem de funcionar, o organismo passa a usar os estoques de gordura para gerar energia. Só que nesse processo em que o corpo usa a gordura como energia, formam-se as cetonas. A equação química para a última etapa deste processo é a seguinte:
H3CCOCH2CO2H → H3CCOCH3 + CO2
A quantidade de acetona, produzida, em valores aproximados, que pode ser produzida a partir de 125 mg do ácido acetoacético, será:
Dados: massa molar (g/mol) C = 12; O = 16; Constante de Avogadro = 6.10 23 mol–1 C + O2 → CO2
Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2 ) pela reação, a quente, de ácido clorídrico (HCℓ) com 6,75 g de alumínio sólido (Aℓ) sob forma de folhas amassadas.
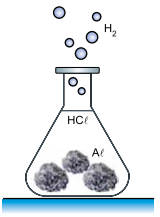
A equação que representa essa reação é:
Aℓ (s) + 3HCl (aq) → AℓCℓ3 (aq) + 3/2H2 (g)
Considere que o hidrogênio seja um gás ideal, que a massa molar do alumínio seja 27 g/mol e que 1 L = 10–3 m3 . Adote para a constante universal do gases o valor R = 8 J/(mol · K). Supondo que todo o gás hidrogênio produzido nessa reação seja armazenado a uma temperatura constante de 27 ºC em um recipiente rígido de volume 10 L, a quantidade de hidrogênio produzida nessas condições ficaria submetida a uma pressão de