Questões de Vestibular
Sobre interações atômicas: geometria molecular, polaridade da ligação e da molécula, forças intermoleculares e número de oxidação. em química
Foram encontradas 335 questões

Considerando as informações apresentadas, qual é o valor de ângulo, para a molécula do diclorometano, entre as ligações H–C–H que mais se aproxima do observado experimentalmente?
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
O metano (CH4), gás amplamente utilizado como combustível, tem sido utilizado como uma alternativa de energia mais limpa em comparação a outros hidrocarbonetos mais pesados. A molécula de metano possui geometria
tetraédrica, com ângulos de ligação de aproximadamente 109,5°, e suas forças intermoleculares são do tipo dispersão de London.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Assinale a opção em que são apresentadas, respectivamente, as geometrias moleculares dos compostos SO2, CH2O, HCN e NH3.
B angular; trigonal plana; linear; e piramidal
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
O modelo de repulsão dos pares eletrônicos da camada de valência (VSEPR), útil para a determinação da geometria de uma molécula, leva em consideração apenas os pares de elétrons que participam da ligação química.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
No modelo VSEPR, as ligações simples, duplas e triplas são igualmente tratadas como conjuntos de elétrons durante a determinação da geometria molecular.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Os ângulos entre as ligações químicas não sofrem interferência da repulsão existente entre os pares de elétrons não compartilhados.
Considerando-se o par de elétrons não ligantes no átomo central, a geometria molecular do composto H3AsO3 é trigonal.
DADOS QUE PODEM SER USADOS

Berilândia, um distrito de Quixeramobim-Ce, além da extração do berílio que lhe deu o nome, é conhecida pela mineração do feldspato, quartzo, mica, gemas, águas marinhas, turmalinas, espudomênio e petalita — estes dois últimos são minérios de lítio que foram descobertos pelo químico, mineralogista e político José Bonifácio de Andrada e Silva. Diante dessas informações, analise as proposições abaixo.
I. O lítio-7 pode ser convertido em berílio-7 pela emissão de uma partícula beta.
II. O hidreto de berílio é o único composto desse metal que tem natureza molecular.
III. Mica, feldspato e quartzo são componentes do granito.
IV. As pedras preciosas e os cristais formaram-se na natureza por cristalização fracionada.
V. O cloreto de berílio apresenta geometria angular e hibridação sp.
Está correto somente o que se afirma em
A partir do texto precedente e considerando que as entalpias de combustão do metano e do 2,2,4-trimetilpentano sejam respectivamente iguais a 890 kJ/mol e 5.464 kJ/mol, julgue o item subsequente.
As moléculas de SO2 são polares, ao passo que as de CO2 são apolares; essa diferença de comportamento pode ser relacionada ao fato de que, no CO2, todos os elétrons de valência do carbono são envolvidos nas ligações covalentes com os átomos de oxigênio, enquanto, no SO2, existe um par de elétrons não ligantes em torno do átomo de enxofre.
A molécula de trióxido de enxofre (SO3) possui geometria espacial do tipo piramidal, já que o átomo de enxofre (S) apresenta um par de elétrons não ligantes ocupando um orbital que faz um ângulo de 109º28’ com as ligações covalentes com os átomos de oxigênio (O).

A energia de interação de uma espécie com outra pode ser entendida como a energia necessária para desfazer a interação entre o SO3 e os compostos estudados (X), como representado na figura ao lado.

Considerando essas informações, é correto afirmar que
A geometria molecular do composto Na2O é similar à da molécula de água.
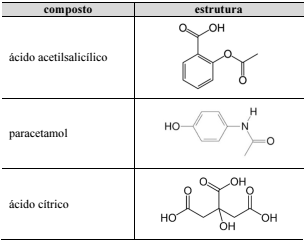
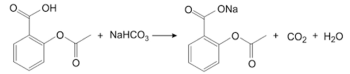
Os compostos orgânicos listados na tabela precedente são amplamente utilizados em medicamentos, entre os quais estão incluídos os efervescentes. Estes resultam da combinação de sólidos misturados e prensados para formar um comprimido contendo o fármaco ácido e um composto básico, como o NaHCO3. Quando o medicamento é colocado na água, a reação entre esses compostos libera CO2, que forma as bolhas na efervescência, como representado para o ácido acetilsalicílico na reação a seguir. Existem, também, vários compostos inorgânicos que são empregados na fabricação de medicamentos, como o FeSO4 e o KMnO4.
Tendo como referência as informações precedentes, julgue o item.
No composto FeSO4, o número de oxidação do átomo de
ferro é +2.
O óxido nitroso é um gás empregado como analgésico em aplicações medicinais. Nesse óxido, o nitrogênio apresenta número de oxidação +1.
A fórmula molecular do óxido nitroso corresponde a:
1. NH4NO3(s) → N2O(g) + H2O(g)
2. N2O(g) → N2(g) + O2(g)
3. Equação Global: NH4NO3(s)→ N2(g) + O2(g) + H2O(g)
Constante universal dos gases: R = 0,082 atm L mol-1 K-1
MM (NH4NO3)= 80 g mol-1
Com base no exposto, analise os questionamentos a seguir.
I) Qual é a soma dos coeficientes estequiométricos inteiros da equação global (balanceada) de decomposição do NH4NO3?
II) Considerando gases ideais, quantos litros de gases serão formados após a decomposição completa de 1,0 Kg de NH4NO3 a 200 °C e 1 atm de pressão? (considerar equação global).
III) Qual a polaridade da molécula de óxido nitroso?
O material adequado para remover esta substância é o
Considerando as informações do texto apresentado, julgue o item a seguir.
O etanol se dissolve facilmente em água, principalmente por ser uma substância polar e por fazer ligações de hidrogênio com a água.
DADOS QUE PODEM SER USADOS NESTA PROVA
