Questões de Vestibular de Química - Interações Atômicas: Ligações Iônicas, Ligações Covalentes e Ligações Metálicas. Ligas Metálicas.
Foram encontradas 44 questões
As lacunas do texto devem ser preenchidas por:
As lacunas do texto devem ser preenchidas por:
Dados: H (Z=1); Cl (Z=17); O (Z=8) e Na (Z=11)
I. Pertencem a mesma função inorgânica. II. O sal citado pode ser obtido da reação de HCl com NaOH. III.Só a água forma pontes de Hidrogênio. IV. Apresentam o mesmo tipo de ligação em sua estrutura.
São corretas apenas:




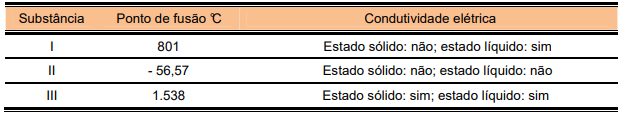
A partir destas informações, pode-se concluir que as substâncias I, II e III, respectivamente, são formadas por ligações:

Há um tipo de ligação interatômica em que os elétrons das camadas mais externas transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a um “mar de elétrons”.
“Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação:
Analise o gráfico que mostra a variação da eletronegatividade em função do número atômico.
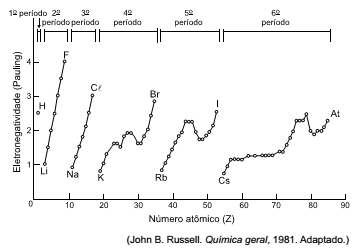
Devem unir-se entre si por ligação iônica os elementos de
números atômicos
O nitreto de boro possui uma estrutura cúbica que se assemelha à estrutura do diamante e uma estrutura hexagonal semelhante à do grafite. Uma das variedades é usada em bases para mascarar rugas, porque reflete a luz. Considerando essa substância, analise as seguintes assertivas:
I. A variedade de nitreto de boro utilizada para cosméticos possui estrutura cúbica.
II. O boro não forma compostos binários iônicos.
III. O boro forma com o nitrogênio ligações covalentes apolares.
IV. O boro cristalino não reage com a água nem com o oxigênio gasoso.
Está correto o que se afirma somente em
Na estratosfera, há um ciclo constante de criação e destruição do ozônio. A equação que representa a destruição do ozônio pela ação da luz ultravioleta solar (UV) é
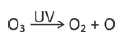
O gráfico representa a energia potencial de ligação entre um dos átomos de oxigênio que constitui a molécula de O3 e os outros dois, como função da distância de separação r.
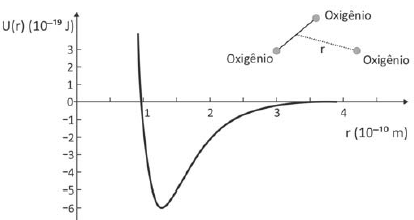
A frequência dos fótons da luz ultravioleta que corresponde à energia de quebra de uma ligação da molécula de ozônio para formar uma molécula de O2 e um átomo de oxigênio é, aproximadamente,
Note e adote:
E = hf
E é a energia do fóton.
f é a frequência da luz.
Constante de Planck, h = 6 x 10-34 J.s
Considerando a informação dada, os tipos de ligações existentes entre as substâncias citadas são, respectivamente:
Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais apresentados na tabela abaixo:
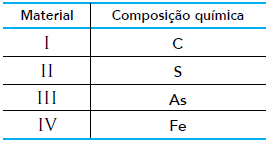
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte
número:

A partir desses resultados, pode-se classificar os compostos X, Y e Z, respectivamente, como sólidos
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
Considerando-se essas informações e as propriedades dos óxidos, é correto afirmar:
As moléculas de dióxido de carbono possuem ligações covalentes polares e, por isso, as interações entre as moléculas de CO2 na neve das calotas polares de Marte são do tipo dipolo permanente-dipolo permanente.

(Dado: 1 mol equivale a 6.1023 moléculas.)

