Questões de Vestibular de Química
Foram encontradas 1.430 questões
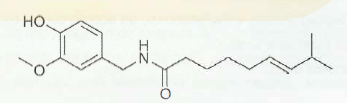
A cadeia carbônica desse composto pode ser classificada como
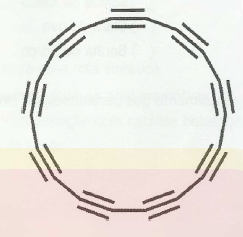
Assinale a alternativa correta em relação ao ciclo[18]carbono.

Adaptado de: <https://www.reddit.com/> . Acesso em: 05 ago. 2019.
O conceito químico, associado a essa tira, pode ser interpretado como
O uso de adoçantes à base de aspartame apresenta uma preocupação para pessoas que possuem fenilcetonúria, que é uma alteração metabólica em que a pessoa não possui no organismo a enzima fenilalanina hidroxilase. O uso desses adoçantes não é aconselhado para essas pessoas porque o aspartame sofre hidrólise no organismo, produzindo o ácido aspártico, o metanol e a fenilalanina. Essa última é transformada pela fenilalanina hidroxilase e, como elas não possuem essa enzima, a fenilalanina irá se acumular no organismo, provocando danos ao sistema nervoso.
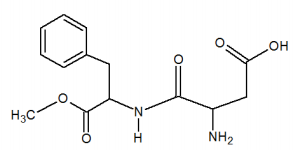
Disponível em: http://www.brasilescola.com/quimica/os-isomerosaspartame-suas-propriedades-adocantes.htm Acesso em nov. 2015.
Observando a estrutura química do aspartame,
representada acima, quais são as funções presentes
na molécula?
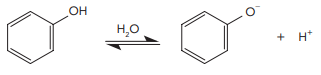
Considere um processamento no qual houve a dissolução completa de 0,01 mol de fenol em água para formar 1 L de solução a 20 °C. Nessa temperatura, a constante de acidez do fenol é igual a 10−10. Atingido o equilíbrio químico da ionização, a concentração de ânion fenolato, em mol/L, na solução, é aproximadamente igual a:
Em um processo de produção industrial, ao adicionar 254 kg de I2 e 80 kg de N2 H4 , verifica-se o consumo completo do reagente limitante. A massa de reagente em excesso, que não foi consumida, em quilogramas, tem valor igual a:
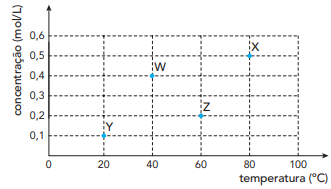
A maior velocidade inicial de formação de gás hidrogênio foi verificada no seguinte experimento:
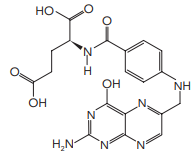
Considere um dado valor de pH, para o qual apenas os hidrogênios das carboxilas do ácido fólico se ionizam. Nessa situação, a carga do ânion formado é igual a:
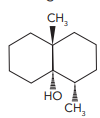
A filtração complementar baseia-se na formação de interações intermoleculares entre a geosmina e o carvão ativado, que é composto basicamente por átomos de carbono. As interações com o carvão ativado no processo de filtração são decorrentes da presença, na molécula de geosmina, do seguinte segmento de cadeia:
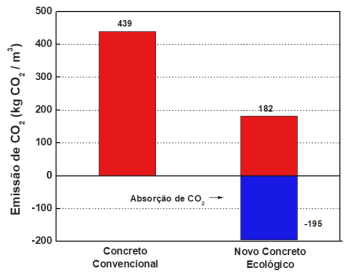 (Adaptado de I. Yoshioka e outros. Energy Procedia 37, 2013, 6018-6025.)
(Adaptado de I. Yoshioka e outros. Energy Procedia 37, 2013, 6018-6025.)De acordo com o estudo, comparando-se o balanço final de CO2 entre o concreto comum e o novo concreto ecológico, após o processo de cura haveria uma diferença no CO2 de cerca de
Dados: volume interno do cilindro = 50 L; volume aproximado do gás a 1 atm de pressão em cada cilindro = 10 m3 ; pressão inicial no cilindro = ~200 atm.
Fe2O3(s) + 3 H2S(g) → Fe2S3(s) + 3 H2O(l)
A partir desses dados, pode-se afirmar que, na condição de remoção máxima de sulfeto de hidrogênio relatada no estudo,
Massas molares (g mol-1): Fe = 56, H = 1, O = 16 e S = 32.
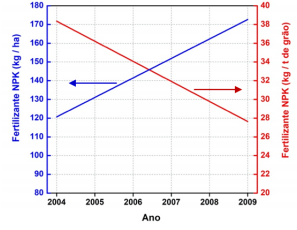
Considerando o caso representado pela figura, pode-se concluir que o sistema de cultivo adotado está influenciando
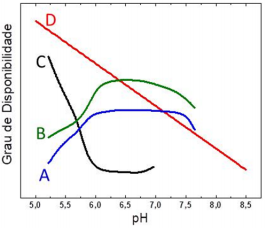
Considerando essas informações e os conhecimentos de química, é correto afirmar que a calagem atua em solos
Éster Fragrância ou sabor Acetato de isoamila Banana Acetato de propila Pera 2-metilbutanoato de etila Maçã verde 2-metilpropanoato de propila Rum Hexanoato de alila Abacaxi Acetato de isobutila Framboesa
Em um laboratório de química orgânica, foram feitas transformações com dois destes ésteres:
I) O éster relativo à fragrância de abacaxi foi hidrolisado em meio ácido. O álcool formado sofreu uma hidrogenação catalítica, gerando o composto A. II) O éster relativo à fragrância de framboesa também foi hidrolisado em meio ácido. O álcool formado foi oxidado na presença de KMnO4/H2SO4, gerando o composto B.
A alternativa que mostra a fragrância do éster formado pela reação entre os compostos AeBem meio ácido é:
Considere que uma colher de sopa de vinagre com um teor de ácido acético de 3,0 % (m/v) foi misturada com 4 colheres de sopa de água para ser usada em limpeza. O valor de pH do vinagre após a diluição é de:
Considere a combustão completa de etanol suficiente para gerar um calor de 1.105 kJ.

Com base na entalpia de formação aproximada dos compostos dados na tabela, a massa de gás carbônico, em kg, liberada nessa queima é de, aproximadamente:
