Questões de Vestibular Comentadas sobre química
Foram encontradas 1.427 questões
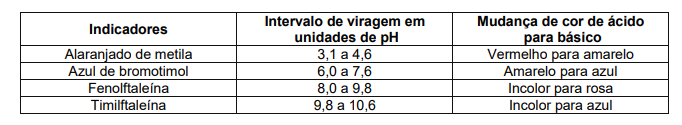
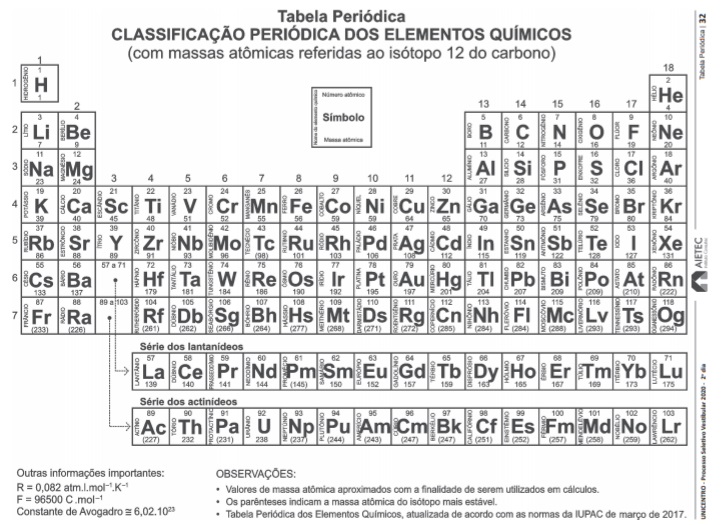
Para diferenciar-se uma solução de pH=5,0 de uma solução de pH=8,0, ambas incolores, deve-se usar o indicador
A capacidade de uma substância se dissolver em outra está associada ao tipo de interação existente entre as partículas. A água, H2O, por exemplo, é considerada solvente universal por dissolver muitas outras substâncias.
As interações intermoleculares existentes na água são do tipo
A representação a seguir ilustra uma mudança de estado físico. Para isso, representou-se a substância por partículas, segundo um determinado modelo atômico.

A mudança de estado físico representada e o modelo atômico utilizado são,
respectivamente,
Uma das substâncias abaixo que possui caráter ácido é
O teste de chama é uma técnica utilizada para identificar átomos ou cátions presentes em substâncias ou misturas. Por exemplo, quando uma pequena quantidade de cloreto de sódio é levada à chama de um bico de Bunsen, observa-se que a chama inicialmente azul adquire uma coloração laranja. Assim, na queima de fogos de artifício, verificamos várias cores devido aos diferentes sais utilizados na fabricação dos fogos.
Essas cores podem ser explicadas pelo modelo atômico de
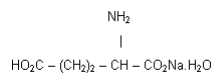
A análise dessa fórmula leva a concluir que esse aditivo
Um estudante de Engenharia Química pipeta 50mL de solução aquosa 0,02mol/L de ácido clorídrico e transfere para um balão volumétrico de 1000mL, ajustando-se para esse volume a solução final, usando água pura.
O pH da solução final é igual a
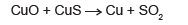
Com base nos conhecimentos sobre cálculos estequiométricos, a massa de cobre obtida quando 159 kg de óxido de cobre reagem completamente com sulfeto de cobre é, aproximadamente,
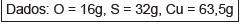
O gás nitrogênio (N2) reage com o gás oxigênio (O2), conforme a reação a seguir:
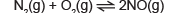
Considere que a constante de equilíbrio da reação é igual a 16 e que as concentrações de equilíbrio de N2 e O2 são, respectivamente, 02mol/L e 02mol/L.
Baseado nos conhecimentos sobre sistemas reversíveis, o valor da concentração molar de NO é igual a
O composto conhecido como tricloroanisol (TCA), encontrada nos grãos de café robusto e em alguns tipos de vinhos, confere a essa variedade de café o cheiro característico de terra. A fórmula estrutural do TCA está representada a seguir.
De acordo com os conhecimentos sobre Química Orgânica e analisando-se a estrutura apresentada, os grupos encontrados são das funções
Os exageros do final de semana podem levar o indivíduo a um quadro de azia. A azia pode ser descrita como uma sensação de queimação no esôfago, provocada pelo desbalanceamento da acidez estomacal. Um dos antiácidos comumente empregados no combate à azia é o leite de magnésia (suspensão de hidróxido de magnésio, Mg(OH)2).
O hidróxido de magnésio quando reage com ácido do estômago constituído de cloro forma o sal de fórmula:
Considere três átomos X, Y e Z. Sabe-se que X e Y são isótopos e que os números de prótons dos átomos envolvidos, quando somados, correspondem a 67, da mesma forma que X e Z são isótonos, e que a soma dos nêutrons dessas três espécies é igual a 94.
O valor do número de massa do átomo Z é igual a
Após o balanceamento da equação iônica, com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Admitindo-se que os potenciais-padrão de redução, E° , do cobre e do cádmio, são, respectivamente, +0,337V e -0,403V, em relação a essa pilha, pode-se afirmar:
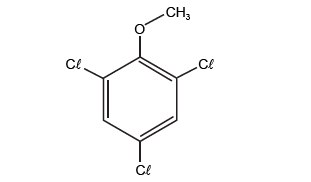
A chuva ácida é a precipitação com a presença de ácido sulfúrico, ácido nítrico e nitroso, resultantes de reações químicas que ocorrem na atmosfera. Todas as chuvas são ácidas, mesmo em ambientes sem poluição conforme mostra a figura apresentada. (A CHUVA, 2019).
A chuva ácida é a denominação de um fenômeno típico que ocorre devido, principalmente,
Em relação ao grupo dos calcogênios, pode-se afirmar:
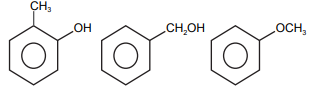
Os compostos orgânicos representados são classificados, respectivamente, como
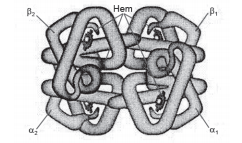
A hemoglobina é uma proteína de estrutura quaternária. Ela é composta por quatro cadeias de globina (parte proteica) e um grupo heme (grupo prostético) ligado a cada uma delas. Em adultos, as cadeias de globina são de dois tipos: duas do tipo α (alfa) e duas do tipo β (beta). O grupo heme contém um átomo de ferro central em seu interior, mantido no estado ferroso. O ferro é o responsável pela captação do oxigênio, uma vez que o mineral se liga ao oxigênio com facilidade. A globina não serve apenas para a função estrutural, mas também torna possível a reversibilidade da ligação entre o ferro e o oxigênio. (A HEMOGLOBLINA, 2019).
A análise dessas informações, da figura apresentada e dos conhecimentos sobre hemoglobina possibilitam afirmar: