Questões de Vestibular Comentadas sobre química
Foram encontradas 1.427 questões
Referência Bibliográfica: https://www.minhavida.com.br/saude/temas/azia. (adaptado).
Os produtos finais gerados a partir da interação entre o bicarbonato de sódio e o HCl estomacal são componentes inorgânicos, quantitativamente identificados pelas seguintes funções inorgânicas:
Texto base para a questão.
A Tiquira é um destilado de mandioca muito popular no Maranhão. Alguns consideram a Tiquira a verdadeira aguardente brasileira por ser feita da mandioca, uma planta nativa.
A aguardente tiquira – destilado produzido a partir do mosto fermentado de mandioca, originalmente incolor, adquire uma cor azulada, em razão da adição de folhas ou de flores de tangerina durante o processo de destilação. A obtenção do álcool, no processo de fermentação, ocorre conforme a reação química a seguir:
C6H12O6 → CO2 + CH3CH2OH
glicose etanol
Alguns produtores informais adicionam um corante chamado violeta de metila, conforme estrutura representada a seguir, que garante um vívido azul-arroxeado à bebida. Na Química, essa substância, é utilizada como um indicador para o intervalo de pH com valores de 0 a 1,6, quando apresenta uma coloração amarelada.
Considere os seguintes dados: C = 12 g.mol -1, H = 1 g.mol -1 e O = 16 g.mol -1.
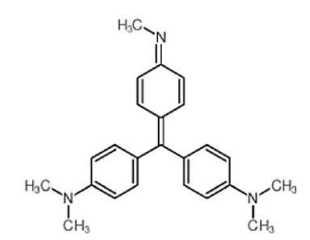
Estrutura química do indicador violeta de metila
Texto base para a questão.
Analise a seguinte situação.
Viajar para o Maranhão é conhecer o casario histórico de São Luís, a beleza de tirar o fôlego dos Lençóis Maranhenses, a cultura do bumba meu boi e comer muito bem e sem culpa. A primeira sugestão é deixar a dieta de lado e mergulhar na culinária maranhense, uma das mais ricas do Brasil.
A base dessa cozinha são os frutos do mar. Um dos principais representantes dessa culinária é a Peixada Maranhense. De origem indígena, tem como ingrediente principal a pescada, mas também pode ser feita com outros peixes. Geralmente preparado em panelas (preferencialmente hermeticamente fechadas) que propiciam a adequada variação de temperatura e de pressão. Porém, após a finalização deste prato, um cheiro forte e característico de peixe exala por toda cozinha, em razão da presença de uma amina, especificamente a trimetilamina
O material disponível mais eficiente para retirada do odor e o tipo de reação que ocorre com a trimetilamina são, respectivamente,
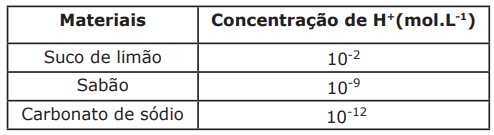
Os pesquisadores chegaram a essa conclusão por uma análise química. Eles pegaram o esmalte dos dentes para descobrir mais sobre a origem dos escravos. O esmalte é a camada externa do dente, formada quase exclusivamente por minerais, e essa composição permanece inalterada durante a vida desse dente. Por isso, ela diz muito sobre a infância de uma pessoa. Os pesquisadores escolheram o elemento químico estrôncio para fazer essa leitura. “O estrôncio é um elemento químico que tem grande afinidade com o cálcio”, explicou um dos pesquisadores. O cálcio é um mineral importante na composição dos ossos e dos dentes, logo o estrôncio também é abundante no corpo humano.
https://g1.globo.com/ciencia-e-saude/noticia/2012/03/analise-quimica-indica-que-escravos-vieram-de-varios-pontos-da-africa.html. Adaptado.
Considere a seguinte afirmativa: “O estrôncio é um elemento químico que tem grande afinidade com o cálcio”. Essa afinidade se justifica porque

O teor desse gás na atmosfera em uma sala, um edifício, um veículo ou em qualquer espaço fechado deve ser mantido a não mais de 0,0039% como um nível de exposição média de oito horas. Baseando-se no quadro anterior, o que poderá acontecer com um indivíduo que ficar em exposição durante um período de oito horas se o nível de monóxido de carbono atingir 0,083%?

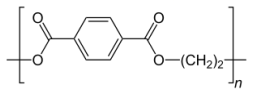
Considerando apenas as ligações entre os átomos de carbonocom carbono e carbono com hidrogênio, os números deligações sigmas (σ), dos tipos: sp3- s ; sp2- sp2; sp2- s, e dotipo pi (π) p - p, encontrados na estrutura do monômero dopolímero PET são

I. os elétrons são distribuídos em subníveis na ordem dos valores crescentes de “n + ℓ“ (nº quântico principal mais nº quântico secundário). II. dois elétrons de um mesmo átomo não podem ter os mesmos quatro números quânticos. III. a ocupação menos estável dos elétrons nos orbitais de um átomo é aquela em que é máximo o número de elétrons desemparelhados. IV. no estado fundamental, os elétrons ocupam os orbitais atômicos de modo que a energia total do átomo seja a máxima possível.
É correto apenas o que se afirma em


Considere a seguinte reação reversível genérica:
A + B ⇌ C + D
O gráfico termoquímico para essa reação está demonstrado na figura a seguir.
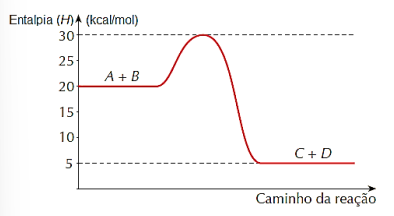
De acordo com os dados do gráfico, assinale
a alternativa correta.


Tendo como referência essas informações, julgue o item seguinte.
Quando o cálcio-41 captura um elétron, é formado o
nuclídeo 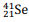 .
.


Tendo como referência essas informações, julgue o item seguinte.
A espécie formada pela ionização do átomo de cálcio possui
raio menor que o do átomo neutro de Ca.