Questões de Vestibular de Química
Foram encontradas 1.430 questões
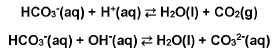
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá:

Numa dada combinação para montar uma pilha eletroquímica, o valor de diferença de potencial (AE) da pilha, no instante em que se ligaram os contatos, foi de 0,69 V.
A combinação utilizada nessa pilha foi entre as semicélulas:
MnO2(s) + H2C2O4(aq) + H2SO4(aq) MnSO4(s) + 2CO2(g) + 2H2O(l)
A implantação de uma empresa de mineração para explorar os recursos naturais de uma região deve considerar os impactos ambientais e a viabilidade econômica do minério que será extraído da crosta terrestre. Para a obtenção do manganês, por exemplo, encontrado em jazidas de pirolusita, que contém o óxido de manganês (IV) e impurezas, é essencial a determinação do teor de MnO2(s), nesse minério, processo realizado em várias etapas em um laboratório. Uma das análises químicas realizadas durante o processo consiste na adição dos ácidos oxálico e sulfúrico, em uma amostra da pirolusita, que reagem de acordo com a equação química.
Considerando-se as informações e as relações estequiométricas entre as substâncias representadas na equação química, é correto concluir:

Cientistas descobriram que a cloração da água para desinfecção produz compostos halogenados secundários, como triclorometano e tribromometano, apresentados na tabela, dentre outras substâncias químicas halogenadas classificadas como carcinogênicas. A recomendação da Organização Mundial da Saúde, OMS, é reduzir a quantidade do cloro adicionada à água e monitorar a concentração dos compostos halogenados para que estejam dentro dos limites estabelecidos.
Com base nas informações e nos dados fornecidos na tabela associados aos conhecimentos sobre a relação entre as estruturas
e propriedades dos compostos moleculares, é correto afirmar:
Leia o texto para responder à questão.
Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
(www.inovacaotecnologica.com.br. Adaptado.)

Leia o texto para responder à questão.
Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
(www.inovacaotecnologica.com.br. Adaptado.)

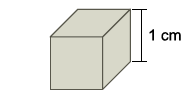
Deseja-se recobrir as faces desse cubo com uma camada uniforme de cobre de 1 × 10–2 cm de espessura. Para isso, o cubo pode ser utilizado como cátodo de uma cuba eletrolítica contendo íons Cu2+(aq). Admita que a eletrólise se realize sob corrente elétrica de 200 mA, que a constante de Faraday seja igual a 1 × 105 C/mol e que a densidade do cobre seja 9 g/cm3 . Assim, estima-se que o tempo de eletrólise necessário para que se deposite no cubo a camada de cobre desejada será próximo de
As antocianinas existem em plantas superiores e são responsáveis pelas tonalidades vermelhas e azuis das flores e frutos. Esses corantes naturais apresentam estruturas diferentes conforme o pH do meio, o que resulta em cores diferentes.
O cátion flavílio, por exemplo, é uma antocianina que apresenta cor vermelha e é estável em pH ≈ 1. Se juntarmos uma solução dessa antocianina a uma base, de modo a ter pH por volta de 5, veremos, durante a mistura, uma bonita cor azul, que não é estável e logo desaparece.
Verificou-se que a adição de base a uma solução do cátion flavílio com pH ≈ 1 dá origem a uma cinética com 3 etapas de tempos muito diferentes. A primeira etapa consiste na observação da cor azul, que ocorre durante o tempo de mistura da base. A seguir, na escala de minutos, ocorre outra reação, correspondendo ao desaparecimento da cor azul e, finalmente, uma terceira que, em horas, dá origem a pequenas variações no espectro de absorção, principalmente na zona do ultravioleta.
(Paulo J. F. Cameira dos Santos et al. “Sobre a cor dos vinhos:
o estudo das antocianinas e compostos análogos não parou
nos anos 80 do século passado”. www.iniav.pt, 2018. Adaptado.)
A variação de pH de ≈1 para ≈5 significa que a concentração de íons H+ (aq) na solução ________ , aproximadamente, _______vezes. Entre as etapas cinéticas citadas no texto, a que deve ter maior energia de ativação e,
portanto, ser a etapa determinante da rapidez do processo
como um todo é a _________.
As lacunas do texto são preenchidas, respectivamente, por:
Analise as estruturas das clorofilas a e b.
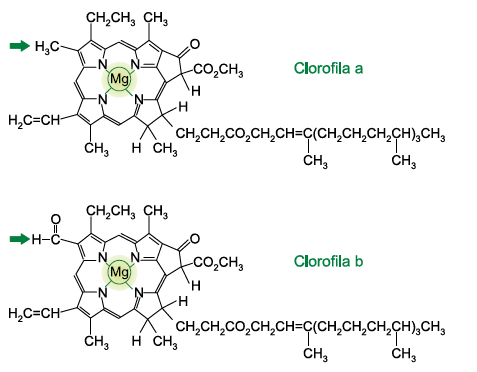
(www.infoescola.com)
As clorofilas a e b estão presentes na estrutura celular denominada __________, sendo que a clorofila ___________é a principal responsável pelo processo de fotossíntese. Nas duas clorofilas, o elemento magnésio encontra-se sob a forma de íons com número de carga _________ . A diferença entre as duas estruturas é a presença, na clorofila b, de um grupo da função orgânica ___________, em vez de um dos grupos metil da clorofila a.
As lacunas do texto são preenchidas, respectivamente, por:

O Parque Eólico de Osório é o maior da América Latina e o segundo maior do mundo em operação. Com capacidade produtiva total de 150 MW, tem potência suficiente para abastecer anualmente o consumo residencial de energia elétrica de cerca de 650 mil pessoas. (www.osorio.rs.gov.br. Adaptado.)
Considere agora a combustão completa do metano, principal componente do gás natural, cuja entalpia de combustão completa é cerca de – 9 × 102 kJ/mol, e que as transformações de energia nessa combustão tenham eficiência ideal, de 100%.
Para fornecer a mesma quantidade de energia obtida pelo Parque Eólico de Osório quando opera por 1 hora com sua capacidade máxima, uma usina termoelétrica a gás necessitaria da combustão completa de uma massa mínima de metano da ordem de
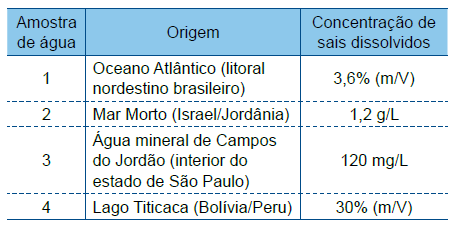
Ao rever essa tabela, o estudante notou que dois dos valores de concentração foram digitados em linhas trocadas. Esses valores são os correspondentes às amostras
O Brasil já é o segundo país que mais realiza a cirurgia bariátrica, que reduz o tamanho do estômago.
O paciente consegue emagrecer porque perde a fome radicalmente — a quantidade de comida consumida cai a um quarto, em média, por falta de espaço. Apesar dos avanços técnicos e das facilidades, a cirurgia está longe de ser uma intervenção simples.
(Natalia Cuminale. “Emagrecer na faca”. Veja, 13.03.2019. Adaptado.)
A principal enzima digestória do suco gástrico e a estrutura química dos monômeros das moléculas sobre as quais atua são
Metais Pesados Padrões Classes 1 e 2 Padrões Classes 3 e 4
Cádmio 0,001 0,01 Chumbo 0,03 0,05 Cobre 0,02 0,5 Cromo Total* 0,1 0,1 Mercúrio 0,0002 0,002 Níquel 0,025 0,025 Zinco 0,18 5,0 <https://tinyurl.com/yyeahxq5> Acesso em: 20.05.2019. Adaptado
Considerando os Padrões Classes 1 e 2, o componente de maior toxidade deve apresentar IT menor, que corresponde ao
Dadas as Massas Molares, em g/mol: Cd Pb Cu Cr Hg Ni Zn 112 207 63,5 52 201 59 65,5
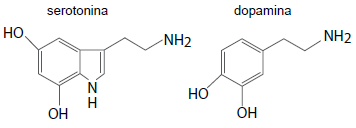
As funções orgânicas presentes nos neurotransmissores representados, são
O principal componente do biogás é o
Considere os dados constantes dos gases ideais: R = 0,082 atm.L/mol.K Massa molar N2: 28 g/mol
A queima de uma substância se dá pela reação de combustão entre um comburente e um combustível. Diversos produtos podem ser formados nesta reação, como H2O, CO2, CO, H2 e CH4. Alguns destes componentes podem causar a chuva ácida que prejudica o meio ambiente com danos aos ciclos biogeoquímicos do planeta e o agravamento do efeito estufa. A combustão completa de uma substância produz gás carbônico e água como produtos. Considere a reação de combustão completa do etileno mostrada abaixo.
C2H4 + 3O2 → 2CO2 + 2H2O
Considere as massas molares de C2H4, O2 e CO2 iguais a 28 g/mol, 32 g/mol e 44 g/mol, respectivamente e assinale a alternativa correta que apresenta quantos gramas de CO2 serão formados com uma massa inicial de C2H4 igual a 2g e de O2 igual a 6g e se a reação é endotérmica ou exotérmica.
Considere a reação entre o ácido ortofosfórico e o hidróxido de cálcio abaixo e assinale a alternativa correta que apresenta o composto X formado e o valor de n conforme a estequiometria da reação balanceada.
2H3PO4 + nCa(OH)2 → X + 6H2O