Questões de Vestibular Comentadas sobre química
Foram encontradas 1.411 questões
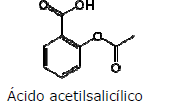
No que diz respeito às características das cadeias carbônicas, é correto afirmar-se que o ácido acetilsalicílico apresenta cadeia carbônica
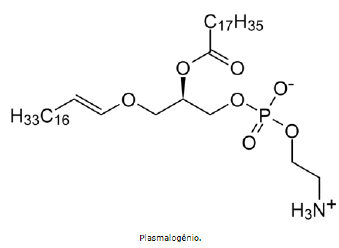
Essas funções bioquímicas estão relacionadas a sua estrutura molecular e possíveis reações e interações químicas. A partir da estrutura apresentada, observamos que
A estrutura química de uma substância orgânica é representada a seguir:
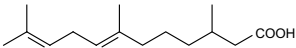
A cadeia carbônica dessa substância se classifica como
O ácido hipúrico, cuja fórmula estrutural está representada abaixo, é um bioindicador da exposição do trabalhador ao tolueno - um solvente aromático muito utilizado em tintas e colas. A biossíntese do ácido hipúrico no organismo ocorre pela reação do tolueno com o aminoácido glicina e, no laboratório, ele pode ser obtido pela reação do cloreto de benzoíla com a glicina em meio alcalino.
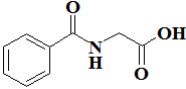
Na estrutura do ácido hipúrico, além do grupo ácido carboxílico, pode-se identificar a função oxigenada
A figura mostra um processo de extração da vanilina a partir de vagens de orquídea espalhadas sobre bandejas perfuradas, em tanques de aço, usando etanol (60% v/v) como solvente. Em geral, a extração dura duas semanas.
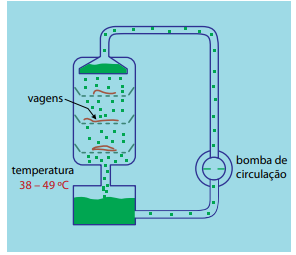
(www.greener-industry.org.uk. Adaptado.)
De acordo com o que mostra a figura, a extração da vanilina a partir de fontes naturais se dá por
Cada estudante recebeu um recipiente contendo 800 mL de água destilada com algumas gotas do indicador de pH alaranjado de metila e soluções de HCl e NaOH em diversas concentrações.
Cada estudante deveria jogar apenas uma vez dois dados, um amarelo e um vermelho, ambos contendo os números de 1 a 6.
• Ao jogar o dado vermelho, o estudante deveria adicionar ao recipiente 100 mL de solução do ácido clorídrico na concentração 10−n mol/L,sendo n o número marcado no dado (por exemplo, se saísse o número 1 no dado, a solução seria de 10−1 mol/L; se saísse 6, a solução seria de 10−6 mol/L). • Ao jogar o dado amarelo, o estudante deveria executar o mesmo procedimento, mas substituindo o ácido por NaOH, totalizando assim 1,0 L de solução. • O estudante deveria observar a cor da solução ao final do experimento.
A professora mostrou a tabela com alguns valores de pH resultantes conforme os números tirados nos dados. Ela pediu, então, aos estudantes que utilizassem seus conhecimentos e a tabela para prever em quais combinações de dados a cor final do indicador seria vermelha.
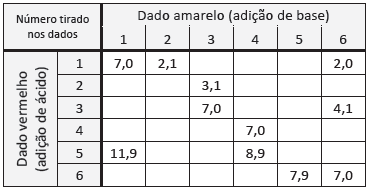
A probabilidade de, após realizar o procedimento descrito, a solução final preparada por um estudante ser vermelha é de:
Note e adote:
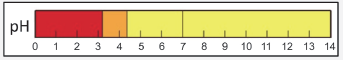
Considere a seguinte relação entre pH do meio e coloração do indicador alaranjado de metila:
Menor que 3,3 3,3 a 4,4 Maior que 4,4 Vermelho Laranja Amarelo
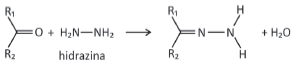
pode ser explorada para a quantificação de compostos cetônicos gerados, por exemplo, pela respiração humana. Para tanto, uma hidrazina específica, a 2,4‐dinitrofenilhidrazina, é utilizada como reagente, gerando um produto que possui cor intensa.
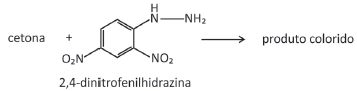
Considere que a 2,4‐dinitrofenilhidrazina seja utilizada para quantificar o seguinte composto:
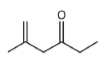
Nesse caso, a estrutura do composto colorido formado será:
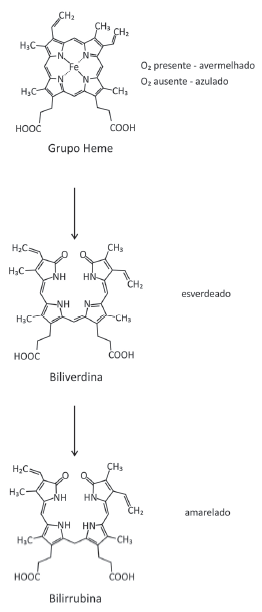
Com base nas informações e nas representações, é correto afirmar:
Considerando um referencial no qual as moléculas neutras encontram‐se paradas antes e após a colisão, a alternativa que melhor representa o arranjo de íons e moléculas instantes antes e instantes depois de uma colisão que leva à reação F − + H3CCl → CH3F + Cl −
é
Note e adote:
Massas atômicas: H = 1 u.m.a., C = 12 u.m.a., F = 19 u.m.a. e Cl = 35 u.m.a. Considere que apenas o isótopo de cloro Cl = 35 u.m.a. participa da reação.
Com base nessas informações e em seus conhecimentos, é correto afirmar:
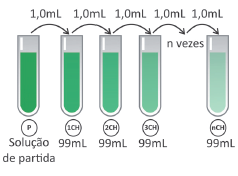
Alguns desses produtos homeopáticos são produzidos com até 200 diluições centesimais sequenciais (200CH).
Considerando uma solução de partida de 100 mL com concentração 1 mol/L de princípio ativo, a partir de qual diluição centesimal a solução passa a não ter, em média, nem mesmo uma molécula do princípio ativo?
Note e adote:
Número de Avogadro = 6×1023.

Note e adote:
Massas molares (g/mol): Licopeno = 537; betanina = 551.


Note e adote:
Temperatura de fusão da sacarose à pressão ambiente = 186 °C; Solubilidade da sacarose a 20 °C = 1,97 kg/L de água.
Ao longo dos anos, diversas descobertas levaram ao crescente aperfeiçoamento dos modelos atômicos. Em relação a esse assunto, faça o que se pede no item, que é do tipo C.
.
Assinale a opção correspondente à figura que melhor ilustra o modelo atômico de Thomson, que sucedeu o modelo de Dalton.

Considere as quatro reações químicas em equilíbrio apresentadas abaixo.
I H2 (g) + I2 (g) ⇋ 2 HI (g)
II 2 SO2 (g) + O2 (g) ⇋ 2 SO3 (g)
III CO (g) + NO2 (g) ⇋ CO2 (g) + NO (g)
IV 2 H2O (g) ⇋ 2 H2(g) + O2 (g)
Após submetê-las a um aumento de pressão, o deslocamento do equilíbrio gerou aumento
também na concentração dos produtos na seguinte reação:
Para a análise do teor de ozônio em um meio aquoso, utiliza-se iodeto de potássio e ácido sulfúrico. Esses compostos reagem conforme a seguinte equação:
x KI + O3 + H2 SO4 → y I2 + H2O + K2SO4
A hemoglobina glicada é um parâmetro de análise sanguínea que expressa a quantidade de glicose ligada às moléculas de hemoglobina. Essa ligação ocorre por meio da reação representada a seguir:
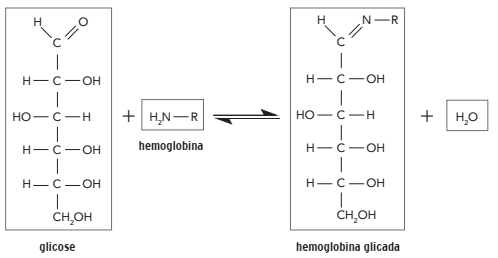
O grupamento funcional da molécula de glicose que reage com a hemoglobina corresponde à
função orgânica denominada:
A produção e a transmissão do impulso nervoso nos neurônios têm origem no mecanismo da bomba de sódio-potássio. Esse mecanismo é responsável pelo transporte de íons Na+ para o meio extracelular e K+ para o interior da célula, gerando o sinal elétrico. A ilustração abaixo representa esse processo.

Para um estudo sobre transmissão de impulsos nervosos pela bomba de sódio-potássio, preparou-se uma mistura contendo os cátions Na+ e K+ , formada pelas soluções aquosas A e B com solutos diferentes. Considere a tabela a seguir:
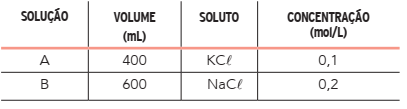
Admitindo a completa dissociação dos solutos, a concentração de íons cloreto na mistura, em
mol/L, corresponde a:
Há um tipo de ligação interatômica em que os elétrons das camadas mais externas transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a um “mar de elétrons”.
“Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação: