Questões de Vestibular Comentadas sobre química
Foram encontradas 1.427 questões
Novas tecnologias de embalagens visam a aumentar o prazo de validade dos alimentos, reduzindo sua deterioração e mantendo a qualidade do produto comercializado. Essas embalagens podem ser classificadas em Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP). As MAP são embalagens fechadas que podem utilizar em seu interior tanto gases como He, Ne, Ar e Kr, quanto composições de CO2 e O2 em proporções adequadas. As EMAP também podem utilizar uma atmosfera modificada formada por CO2 e O2 e apresentam microperfurações na sua superfície, conforme ilustrado abaixo.

Adaptado de exclusive.multibriefs.com
Observe abaixo as fórmulas estruturais espaciais dos principais compostos do óleo de citronela, produto empregado como repelente de mosquitos.
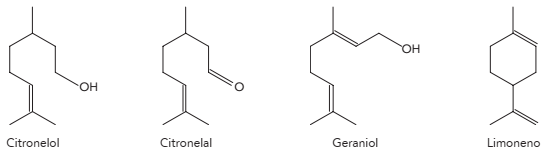
Considerando essas fórmulas estruturais, a quantidade de compostos que apresentam isômeros
espaciais geométricos é igual a:
A fórmula representa a estrutura da butanona, também conhecida como metiletilcetona (MEK), importante solvente industrial usado em tintas e resinas.
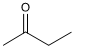
Um isômero da butanona é o
No que diz respeito aos ciclos de combustíveis nucleares empregados nos reatores, a expressão “fértil” refere-se ao material que produz um nuclídeo físsil após captura de nêutron, sendo que a expressão “físsil” refere-se ao material cuja captura de nêutron é seguida de fissão nuclear.
(José Ribeiro da Costa. Curso de introdução ao estudo dos ciclos de combustível, 1972. Adaptado.)
Assim, o nuclídeo Th-232 é considerado fértil, pois produz nuclídeo físsil, pela sequência de reações nucleares:
232Th + 1n → 233Th → 233Pa + β–
233Pa → nuclídeo físsil + β–
O nuclídeo físsil formado nessa sequência de reações é o
Para sua apresentação em um “show de química”, um grupo de estudantes confeccionou um recipiente com três compartimentos, 1, 2 e 3, dispostos de modo a lembrar o formato da bandeira brasileira. A esses compartimentos, adicionaram três soluções aquosas diferentes, todas incolores e de concentração igual a 0,1 mol/L, uma em cada compartimento. O recipiente foi mantido em posição horizontal.
Em seguida, acrescentaram em cada compartimento o indicador azul de bromotimol, que apresenta cor azul em pH > 7,6 e amarela em pH < 6,0. Como resultado, o recipiente apresentou as cores da bandeira nacional, conforme mostra a figura.
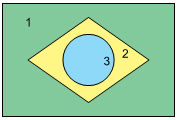
As soluções aquosas colocadas inicialmente pelos estudantes
nos compartimentos 1, 2 e 3 podem ter sido, respectivamente,
Analise o gráfico que mostra a variação da eletronegatividade em função do número atômico.
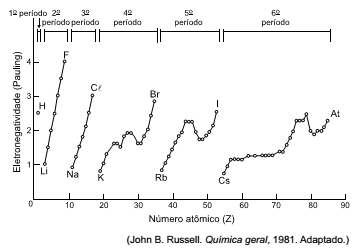
Devem unir-se entre si por ligação iônica os elementos de
números atômicos
Dos extensos efeitos nocivos que a radiação ionizante provoca na matéria viva, afigura-se a geração de radicais livres, que são espécies químicas eletricamente neutras que apresentam um ou mais elétrons desemparelhados na camada de valência. O íon cloreto, por exemplo, que, quantitativamente, constitui o principal ânion do plasma, transforma-se no radical livre Cℓ●, com 7 elétrons na camada de valência, podendo, assim, reagir facilmente com as biomoléculas, alterando o comportamento bioquímico de muitas proteínas solúveis do meio sanguíneo e também os constituintes membranários de células: hemácias, leucócitos, plaquetas.
(José Luiz Signorini e Sérgio Luís Signorini. Atividade física e radicais livres, 1993. Adaptado.)
Ao transformar-se em radical livre, o ânion cloreto
O cloreto de cobalto(II) anidro, CoCℓ2 , é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexa-hidratado, CoCℓ2 .6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa) 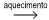 sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de 0,1 mol de sal hidratado é, aproximadamente,
O quadro fornece indicações sobre a solubilidade de alguns compostos iônicos inorgânicos em água a 20 ºC.
Em um laboratório, uma solução aquosa obtida a partir da
reação de uma liga metálica com ácido nítrico contém nitrato
de cobre(II) e nitrato de prata. Dessa solução, pretende-se
remover, por precipitação, íons de prata e íons de cobre(II),
separadamente. Para tanto, pode-se adicionar à mistura uma
solução aquosa de
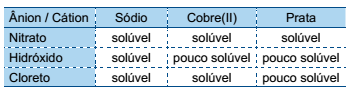
Após a análise de sua estrutura química, constata-se que essa molécula apresenta
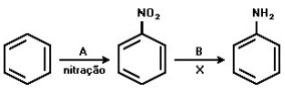
Nesse esquema, A, B, e X correspondem, respectivamente, a:
C6H12O6
 2 C2H5OH + 2 CO2
2 C2H5OH + 2 CO2 Sendo os calores de formação da glicose, do gás carbônico e do álcool, respectivamente, –302, –94 e –66 kcal/mol, pode-se afirmar que a fermentação ocorre com:
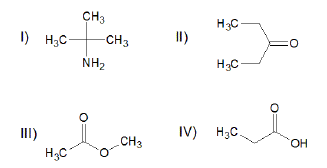
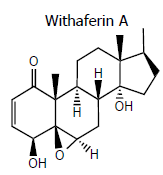
Entre as funções orgânicas presentes na Withaferin A, estão
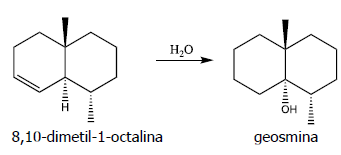
Considere as seguintes informações, a respeito da 8,10-dimetil-1-octalina e da geosmina.
I - A 8,10-dimetil-1-octalina é um hidrocarboneto alifático insaturado.
II - A geosmina é um heterociclo saturado.
III- Cada um dos compostos apresenta dois carbonos quaternários.
Quais estão corretas?
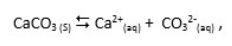
onde Kps é a constante do produto de solubilidade
A afirmação incorreta encontra-se na afirmativa
