Questões de Vestibular Comentadas sobre química
Foram encontradas 1.430 questões
O dióxido de titânio, além de ser empregado como aditivo alimentar, é comumente usado para pigmentação branca em tintas, papel e plásticos. É também um ingrediente ativo, em protetores solares baseados em minerais, usado para a pigmentação com o objetivo de bloquear a luz ultravioleta. Além disso, o óxido também é usado em alguns chocolates para dar uma textura suave; em donuts, para fornecer cor; e em leites desnatados, para dar uma aparência mais brilhante, mais opaca, o que torna o produto mais saboroso.
Uma das reações utilizadas para a sua produção é a cloração de um mineral de titânio (ilmenita) cuja equação é a seguinte:
x FeTiO3 (s) + y Cl2 (g) + z C(s) → a FeCl2 (s) + bTiO2(s) + c CO2 (g)
Os números para os coeficientes x, y, z, a, b, c, que tornam
essa equação balanceada, são, respectivamente:
Assinale a opção que completa correta e respectivamente o seguinte enunciado: “Muitas substâncias orgânicas têm em sua estrutura um ciclo formado por _____________1 átomos de carbono com três ligações duplas _____________2.
Compostos que têm esse ciclo são chamados de _____________3”.
Atente para as seguintes afirmações:
I. Café, quando embalado a vácuo, tem uma vida útil mais longa, porque é mantido na ausência de oxigênio, que participa de grande parte das reações de decomposição dos alimentos, além de ser essencial para o metabolismo dos microrganismos responsáveis por essas degradações.
II. A vida útil do coco verde exportado para a Europa se prolonga até 60 dias se ele é revestido com uma fina camada de parafina, porque a parafina serve de “embalagem” impermeável ao oxigênio do ar e à umidade atmosférica, impedindo que as substâncias do coco passíveis de sofrer degradação entrem em contato com esses agentes.
III. Uma simples camada de pintura de “zarcão” (basicamente um óxido de chumbo) protege o ferro da corrosão, porque a película formada por esse óxido sobre o ferro impede o contato entre esse metal e o oxigênio e a umidade do ar, evitando sua corrosão.
É correto o que se afirma em
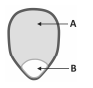
Um grão de milho de pipoca, visto a olho nu, apresenta duas regiões distintas, representadas por A e B na figura. Em A, ocorre o tecido acumulador de amido, usado, pela planta, para nutrir o embrião. Em B, os tecidos vegetais possuem maior teor de água.
Ao ser aquecida, parte da água transforma‐se em vapor, aumentando a pressão interna do grão. Quando a temperatura atinge 177°C, a pressão se torna suficiente para romper o grão, que vira uma pipoca.
Um estudo feito por um grupo de pesquisadores determinou que o interior do grão tem 4,5 mg de água da qual, no momento imediatamente anterior ao seu rompimento, apenas 9% está na fase vapor, atuando como um gás ideal e ocupando 0,1 mL. Dessa forma, foi possível calcular a pressão Pfinal no momento imediatamente anterior ao rompimento do grão.
A associação correta entre região do milho e Pfinal é dada por:
Note e adote:
Constante universal dos gases: R = 0,082 L.atm/(K.mol); K = °C + 273;
Massas molares (g/mol): H = 1; O = 16.
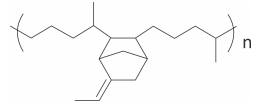
A bola de futebol que foi utilizada na Copa de 2018 foi chamada Telstar 18. Essa bola contém uma camada interna de borracha que pertence a uma classe de polímeros genericamente chamada de EPDM. A fórmula estrutural de um exemplo desses polímeros é
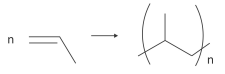
Polímeros podem ser produzidos pela polimerização de compostosinsaturados(monômeros) como exemplificado para o polipropileno (um homopolímero):
Os monômeros que podem ser utilizados para preparar o co‐
polímero do tipo EPDM, cuja fórmula estrutural foi
apresentada, são
Uma postagem de humor na internet trazia como título “Provas de que gatos são líquidos” e usava, como essas provas, fotos reais de gatos, como as reproduzidas aqui.

O efeito de humor causado na associação do título com asfotos baseia‐se no fato de que líquido
Note e adote:
Considere temperatura e pressão ambientes.
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
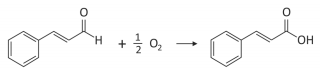
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.
O gráfico a seguir indica a temperatura de ebulição de bromoalcanos (CnH2n+1Br) para diferentes tamanhos de cadeia carbônica.
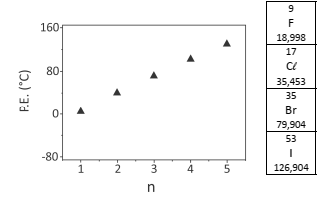
Considerando as propriedades periódicas dos halogênios, a
alternativa que descreve adequadamente o comportamento
expresso no gráfico de temperaturas de ebulição versus
tamanho de cadeia carbônica para CnH2n+1F ( )
e CnH2n+1I (•) é:
)
e CnH2n+1I (•) é:
Note e adote:
P.E. = ponto de ebulição
Em um experimento, determinadas massas de ácido maleico e acetona foram misturadas a 0 °C, preparando‐se duas misturas idênticas. Uma delas (X) foi resfriada a ‐78 °C, enquanto a outra (M) foi mantida a 0 °C. A seguir, ambas as misturas (M e X) foram filtradas, resultando nas misturas N e Y. Finalmente, um dos componentes de cada mistura foi totalmente retirado por destilação. Os recipientes (marcados pelas letras O e Z) representam o que restou de cada mistura após a destilação. Nas figuras, as moléculas de cada componente estão representadas por retângulos ou triângulos.
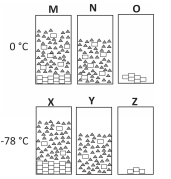
Tanto no recipiente M como no recipiente X, estão representadas soluções ___I___ de ___II___, cuja solubilidade ___III___ com a diminuição da temperatura. A uma determinada temperatura, as concentrações em M e N e em X e Y são ___IV___. Em diferentes instantes, as moléculas representadas por um retângulo pertencem a um composto que pode estar ___V___ ou no estado ___VI___.
As lacunas que correspondem aos números de I a VI devem ser corretamente preenchidas por:
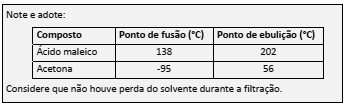
Peptídeos podem ser analisados pelo tratamento com duas enzimas. Uma delas, uma carboxipeptidase, quebra mais rapidamente a ligação peptídica entre o aminoácido que tem um grupo carboxílico livre e o seguinte. O tratamento com outra enzima,uma aminopeptidase, quebra,maisrapidamente, a ligação peptídica entre o aminoácido que tem um grupo amino livre e o anterior. Isso permite identificar a sequência dos aminoácidos no peptídeo.
Um tripeptídeo, formado pelos aminoácidos lisina, fenilalanina e glicina, não necessariamente nessa ordem, foi submetido a tratamento com carboxipeptidase, resultando em uma mistura de um dipeptídeo e fenilalanina. O tratamento do mesmo tripeptídeo com aminopeptidase resultou em uma mistura de um outro dipeptídeo e glicina.
O número de combinações possíveis para os três aminoácidos e a fórmula estrutural do peptídeo podem ser, respectivamente,
Um antiácido comercial em pastilhas possui, em sua composição, entre outras substâncias, bicarbonato de sódio, carbonato de sódio e ácido cítrico. Ao ser colocada em água, a pastilha dissolve‐se completamente e libera gás carbônico, o que causa a efervescência. Para entender a influência de alguns fatoressobre a velocidade de dissolução da pastilha, adicionou‐ se uma pastilha a cada um dos quatro recipientes descritos na tabela, medindo‐se o tempo até a sua dissolução completa.
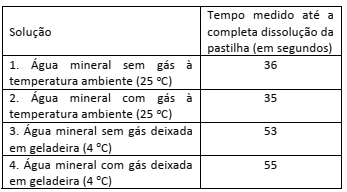
Para todos os experimentos, foi usada água mineral da mesma marca. Considere a água com gás como tendo gás carbônico dissolvido.
Com base nessas informações, é correto afirmar que
Uma amostra sólida, sem cavidades ou poros, poderia ser constituída por um dosseguintes materiais metálicos: alumínio, bronze, chumbo, ferro ou titânio. Para identificá‐la, utilizou‐se uma balança, um recipiente de volume constante e água. Efetuaram‐se as seguintes operações: 1) pesou‐se a amostra; 2) pesou‐se o recipiente completamente cheio de água; 3) colocou‐se a amostra no recipiente vazio, completando seu volume com água e determinou‐se a massa desse conjunto. Os resultados obtidos foram os seguintes:
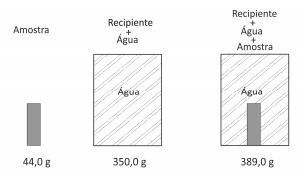
Dadas as densidades da água e dos metais, pode‐se concluir que a amostra desconhecida é constituída de
Note e adote:
Densidades (g/cm3 ):
água = 1,0; alumínio = 2,7; bronze = 8,8;
chumbo = 11,3; ferro = 7,9; titânio = 4,5.
