Questões de Vestibular de Química
Foram encontradas 1.430 questões
A seguir são apresentados nomes de alguns aldeídos e cetonas que podem ser preparados por oxidação de um álcool adequado: etanol, propanona, 2-metilpropanal e 2-pentanona.
A opção que apresenta as fórmulas estruturais dos álcoois que dão origem, por oxidação, aos compostos citados na ordem apresentada é:
Na produção de sabão, uma amostra de 100 g de hidróxido de sódio reage com a estearina, de acordo com a reação não balanceada a seguir:
(C17H35COO)3C3 H5(s) + NaOH(aq) → C17H35COONa(s) + C3H5 (OH)3( l )
Considerando que, a partir de 100 g de hidróxido de
sódio, foram obtidos 512 g de estearato de sódio, o rendimento
deste procedimento é aproximadamente igual a
Tem-se a seguinte célula: Mn2+ (0.1 M) + O2 (1 atm) + 2H2O ⇄ MnO2 + H2O2 (0.1 M) + 2H+ (0.1 M).
Considere que na temperatura ambiente os valores dos potenciais padrão das espécies constituintes da célula, são:
O2 + 2H+ + 2e− ⇄ H2O2 E0 = + 0.68 V
MnO2 + 4H+ + 2e− ⇄ Mn2+ + 2H2O E0 = + 1.23 V
A direção que a reação vai tomar e o potencial
gerado são respectivamente:
Um volume de 16.42 mL de uma solução de permanganato de potássio 0.1327 M é necessário para oxidar 20.00 mL de uma solução de FeSO4 em meio ácido.
Considere que a equação não balanceada representativa da reação é:
Fe2+ + MnO4 − + H+ → Mn2+ + Fe3+ + H2O
A concentração da solução do sal de ferro será
aproximadamente:
Em um acidente no laboratório, um frasco contendo 2.0 kg de NaOH foi quebrado e, para neutralizar essa soda foi proposta a reação
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l),
que liberou 660 Kcal. Se 1 cal = 4.18 J, a variação da
entalpia de neutralização, em kJ mol-1, é igual a:
Com base nas informações sobre os valores de potenciais de redução, a 25º C:
Mg+2(aq) + 2 e- ⇄ Mg (s) E° = - 2.4 V
Cu+2(aq) + 2 e- ⇄ Cu (s) E° = + 0.34 V
É correto afirmar que:
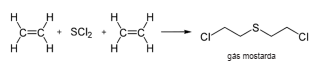
A partir da reação abaixo o volume aproximado, em metros cúbicos de etileno (d=1.18 kg/m3 ), necessário para preparar 2.0 toneladas de gás mostarda é:
O ácido láctico é um composto orgânico de função mista que apresenta fórmula CH3 CH(OH)COOH. O organismo humano produz ácido láctico em quantidades expressivas durante a realização de exercícios físicos, sendo produzido excessivamente quando esses se intensificam. No ambiente celular, o ácido láctico transforma-se em lactato, que é a sua forma ionizada. A mistura de ácido láctico e lactato de sódio, em solução aquosa, funciona como uma solução-tampão, ou seja, como, praticamente, aquela que não muda seu pH pela adição de H+ ou OH- em pequenas quantidades.
Supondo uma solução contendo 0.15 mol/L de ácido láctico e 0.15 mol/L de lactato de sódio (Ka = 1.0 x 10-4) e negligenciando a quantidade de ácido que ioniza, o valor do pH será igual a :
A Astaxantina é um carotenoide que, ao contrário de outros, não se converte em Vitamina A no corpo humano, sendo um poderoso antioxidante e componente nutricional natural.
Com massa molar de aproximadamente 596 g/mol e fórmula centesimal C (80.54%), H (8.72%) e O (10.74%), esse carotenoide é representado pela fórmula molecular:
O uísque é uma bebida rigorosamente regulamentada. Possui denominações de origem e várias classes e tipos, cuja característica comum é a fermentação dos grãos e a destilação máxima de 80% de álcool para os de milho e 90% de álcool para os de outros grãos, antes da adição de água, com vistas à retenção dos sabores dos grãos usados para fazer a alcoolização.
Esse álcool é o etanol somado a pequenas quantidades de outras substâncias, dentre as quais, ácido acético e acetato de etila. Estas duas últimas substâncias teriam se formado, a partir do etanol, respectivamente, por reações de
A metilona – um derivado das anfetaminas – produz efeitos semelhantes aos do ecstasy (MDMA), sendo, portanto, um estimulante gerador de euforia e de mais energia e capaz, também, de alterar a percepção sensorial.
Observe a fórmula estrutural da metilona, apresentada a seguir.
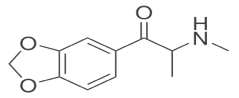
A metilona possui:
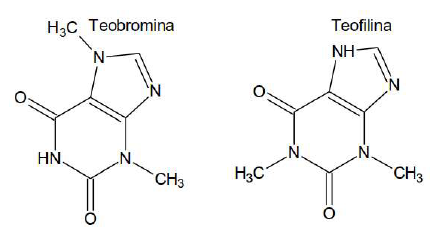
Amplamente comercializado, em todo o Brasil, sobretudo por seu valor energético, o açaí contém antocianinas, substâncias responsáveis pelas colorações nos tons de azul, vermelho e arroxeado em diversos tecidos vegetais, especialmente em flores e frutos. As antocianinas mudam sua coloração conforme a acidez ou basicidade do meio em que se encontram. Isso faz com que o extrato de açaí possa atuar como um indicador ácido-base. O extrato de açaí, por exemplo, torna-se avermelhado em soluções ácidas (pH<7), esverdeado em soluções básicas (pH>7) e roxo claro em soluções neutras (pH=7).
Observando a figura abaixo, as substâncias que, em presença de extrato de açaí, apresentariam, respectivamente, colorações avermelhadas, esverdeadas e arroxeadas são:

Disponível em: <https://www.dicasnutricao.com.br/estimulantes-do-cha/.> Acesso em 25/03/2018.
As substâncias citadas possuem as seguintes fórmulas moleculares
Disponível em: <http://4.bp.blogspot.com/Captura_de_tela-13.png.> Acesso em 25/03/2018.
Essas substâncias são
Na situação de equilíbrio para a reação
2S02(g) + O2(g) ⇄ 2SO3(g)
as concentrações de reagentes e produtos a 1000 K foram determinadas como sendo [SO2] = 0.27 m ol.L-1, [O2] = 0.40 mol.L-1 e [SO3] = 0.33 m ol.L-1.
Na temperatura dada, o valor da constante de equilíbrio da
reação em termos de concentração será:
A calcinação de 2.8400 g de uma mistura sólida constituída de CaCO3 e MgCO3 produziu um gás e um resíduo sólido de peso 1.5200 g.
Com essas informações, é correto afirmar que