Questões de Vestibular Comentadas sobre química
Foram encontradas 1.411 questões
Atente às seguintes proposições a respeito de compostos orgânicos:
I. Nos compostos orgânicos, os pontos de fusão e ebulição, em geral, são mais altos do que nas substâncias inorgânicas.
II. Depois do carbono e do hidrogênio, o oxigênio é o elemento químico de maior presença nos compostos orgânicos.
III. Na natureza, os ácidos carboxílicos estão presentes principalmente nos ésteres que constituem os óleos e as gorduras.
IV. Atualmente o éter comum (etóxi-etano) é muito usado como solvente polar tanto em laboratório como nas indústrias químicas.
Está correto o que se afirma somente em
Considerando a equação de formação da glicose não balanceada C + H2 + O2 → C6H12O6 , atente às seguintes equações:
I. C + O2 → CO2 ΔH = −94,1 kcal
II. H2 + ½ O2 → H2O ΔH = −68,3 kcal
III. C6H12O6 + 6O2 → 6CO2 + 6 H2O ΔH = −673,0 kcal
A massa de glicose formada a partir da reação de 14,4 g de carbono e sua entalpia de formação em kcal/mol serão, respectivamente,
Considere as figuras pelas quais são representados diferentes sistemas contendo determinadas substâncias químicas. Nas figuras, cada círculo representa um átomo, e círculos de tamanhos diferentes representam elementos químicos diferentes.
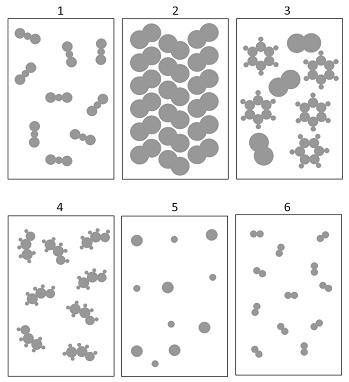
A respeito dessas representações, é correto afirmar que os
sistemas
Em um laboratório químico, foi encontrado um frasco de vidro contendo um líquido incolor e que apresentava o seguinte rótulo:
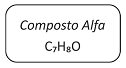
Para identificar a substância contida no frasco, foram feitos os seguintes testes:
I. Dissolveram-se alguns mililitros do líquido do frasco em água, resultando uma solução neutra. A essa solução, adicionaram-se uma gota de ácido e uma pequena quantidade de um forte oxidante. Verificou-se a formação de um composto branco insolúvel em água fria, mas solúvel em água quente. A solução desse composto em água quente apresentou pH = 4.
II. O sólido branco, obtido no teste anterior, foi dissolvido em etanol e a solução foi aquecida na presença de um catalisador. Essa reação produziu benzoato de etila, que é um éster aromático, de fórmula C9H10O2.
Com base nos resultados desses testes, concluiu-se que o
Composto Alfa é:
Um método largamente aplicado para evitar a corrosão em estruturas de aço enterradas no solo, como tanques e dutos, é a proteção catódica com um metal de sacrifício. Esse método consiste em conectar a estrutura a ser protegida, por meio de um fio condutor, a uma barra de um metal diferente e mais facilmente oxidável, que, com o passar do tempo, vai sendo corroído até que seja necessária sua substituição.
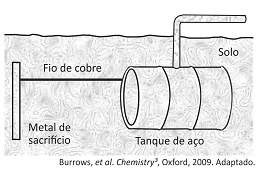
Um experimento para identificar quais metais podem ser utilizados como metal de sacrifício consiste na adição de um pedaço de metal a diferentes soluções contendo sais de outros metais, conforme ilustrado, e cujos resultados são mostrados na tabela. O símbolo ( + ) indica que foi observada uma reação química e o (-) indica que não se observou qualquer reação química.
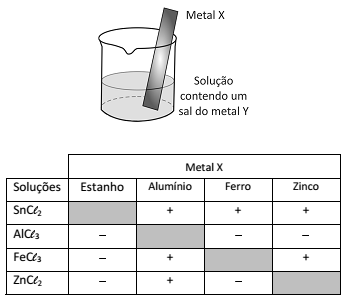
Da análise desses resultados, conclui-se que pode(m) ser utilizado(s) como metal(is) de sacrifício para tanques de aço:
Note e adote:o aço é uma liga metálica majoritariamente formada pelo elemento ferro.
A energia liberada na combustão do etanol de cana-de-açúcar pode ser considerada advinda da energia solar, uma vez que a primeira etapa para a produção do etanol é a fotossíntese. As transformações envolvidas na produção e no uso do etanol combustível são representadas pelas seguintes equações químicas:
6 CO2 (g) + 6 H2O (g) → C6H12O6 (aq) + 6 O2 (g)
C6H12O6 (aq) → 2 C2H5OH (ℓ) + 2 CO2 (g) ΔH = - 70 kJ/mol
C2H5OH (ℓ ) + 3O2(g) → 2 CO2 (g) + 3 H2O (g) ΔH = - 1.235 kJ/mol
Com base nessas informações, podemos afirmar que o valor de ΔH para a reação de fotossíntese é
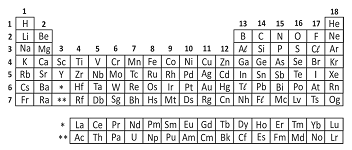
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
I. Tem massa atômica maior do que a do selênio (Se).
II. Pode formar com o hidrogênio um composto molecular de fórmula H2S.
III. A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
IV. Pode formar com o sódio (Na) um composto iônico de fórmula Na3S.
São corretas apenas as afirmações
Um dos parâmetros que determina a qualidade do azeite de oliva é sua acidez, normalmente expressa na embalagem na forma de porcentagem, e que pode ser associada diretamente ao teor de ácido oleico em sua composição.
Uma amostra de 20,00 g de um azeite comercial foi adicionada a 100 mL de uma solução contendo etanol e etoxietano (dietiléter), 1:1 em volume, com o indicador fenolftaleína. Sob constante agitação, titulou-se com uma solução etanólica contendo KOH 0,020 mol/L até a ________________ total. Para essa amostra, usaram-se 35,0 mL de base, o que permite concluir que se trata de um azeite tipo ________________.

As palavras que completam corretamente as lacunas são:
A mandioca, uma das principais fontes de carboidratos da alimentação brasileira, possui algumas variedades conhecidas popularmente como “mandioca brava”, devido a sua toxicidade. Essa toxicidade se deve à grande quantidade de cianeto de hidrogênio (HCN) liberado quando o tecido vegetal é rompido.
Após cada etapa do processamento para a produção de farinha de mandioca seca, representado pelo esquema a seguir, quantificouse o total de HCN nas amostras, conforme mostrado no gráfico que acompanha o esquema.
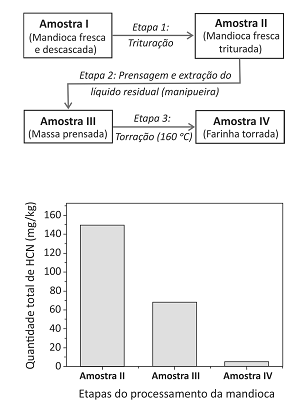
O que ocorre com o HCN nas Etapas 2 e 3?
Uma determinada quantidade de metano (CH4) é colocada para reagir com cloro (Cℓ2) em excesso, a 400 °C, gerando HCℓ(g) e os compostos organoclorados H3CCℓ , H2CCℓ2, HCCℓ3, CCℓ4, cujas propriedades são mostradas na tabela. A mistura obtida ao final das reações químicas é então resfriada a 25 °C, e o líquido, formado por uma única fase e sem HCℓ, é coletado.
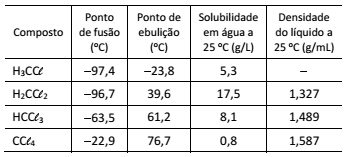
A melhor técnica de separação dos organoclorados presentes
na fase líquida e o primeiro composto a ser separado por essa
técnica são:
Uma das substâncias utilizadas em desinfetantes comerciais é o perácido de fórmula CH3CO3H.
A formulação de um dado desinfetante encontrado no comércio consiste em uma solução aquosa na qual existem espécies químicas em equilíbrio, como representado a seguir. (Nessa representação, a fórmula do composto 1 não é apresentada.)
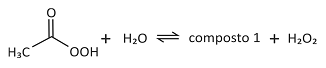
Ao abrir um frasco desse desinfetante comercial, é possível sentir o odor característico de um produto de uso doméstico.
Esse odor é de
Em análises metalúrgicas, emprega-se uma solução denominada nital, obtida pela solubilização do ácido nítrico em etanol.
Um laboratório de análises metalúrgicas dispõe de uma solução aquosa de ácido nítrico com concentração de 60% m/m e densidade de 1,4 kg/L. O volume de 2,0 mL dessa solução é solubilizado em quantidade de etanol suficiente para obter 100,0 mL de solução nital.
Com base nas informações, a concentração de ácido nítrico, em g.L−1 , na solução nital é igual a:
A capacidade poluidora de um hidrocarboneto usado como combustível é determinada pela razão entre a energia liberada e a quantidade de CO2 formada em sua combustão completa. Quanto maior a razão, menor a capacidade poluidora. A tabela abaixo apresenta a entalpia-padrão de combustão de quatro hidrocarbonetos.

A partir da tabela, o hidrocarboneto com a menor capacidade poluidora é:
A exposição ao benzopireno é associada ao aumento de casos de câncer. Observe a fórmula estrutural dessa substância:
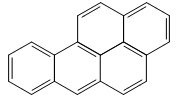
Com base na fórmula, a razão entre o número de átomos de carbono e o de hidrogênio,
presentes no benzopireno, corresponde a:
No século XIX, o cientista Svante Arrhenius definiu ácidos como sendo as espécies químicas que, ao se ionizarem em solução aquosa, liberam como cátion apenas o íon H+ . Considere as seguintes substâncias, que apresentam hidrogênio em sua composição: C2H6 , H2SO4 , NaOH, NH4Cl.
Dentre elas, aquela classificada como ácido, segundo a definição de Arrhenius, é:
Quatro balões esféricos são preenchidos isotermicamente com igual número de mols de um gás ideal. A temperatura do gás é a mesma nos balões, que apresentam as seguintes medidas de raio:
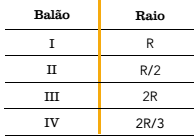
A pressão do gás é maior no balão de número:
