Questões de Vestibular Comentadas sobre química
Foram encontradas 1.427 questões
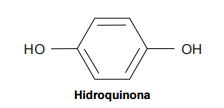
A função orgânica que caracteriza esse composto é


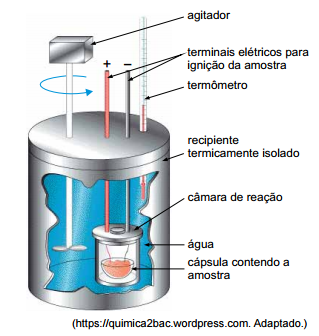
A tabela nutricional de determinado tipo de azeite de oliva traz a seguinte informação: “Uma porção de 13 mL (1 colher de sopa) equivale a 108 kcal.” Considere que o calor específico da água seja 1 kcal · kg–1 · ºC–1 e que todo o calor liberado na combustão do azeite seja transferido para a água. Ao serem queimados 2,6 mL desse azeite, em um calorímetro contendo 500 g de água inicialmente a 20,0 ºC e à pressão constante, a temperatura da água lida no termômetro deverá atingir a marca de
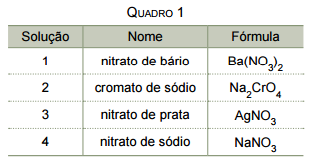
O quadro 2 apresenta o resultado das misturas, de volumes iguais, de cada duas dessas soluções.
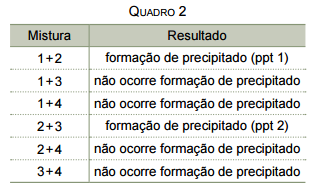
De acordo com essas informações, os precipitados formados, ppt 1 e ppt 2, são, respectivamente,
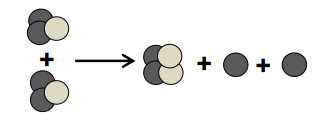
De acordo com esse esquema, pode-se concluir que essa transformação, que liberaria muita energia, é uma
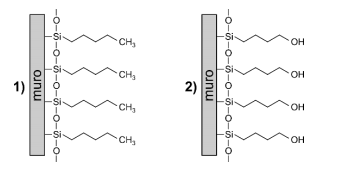
Como a urina é constituída majoritariamente por água, e levando-se em conta as forças intermoleculares, pode-se afirmar corretamente que
Relacione corretamente as equações com as reações químicas do cotidiano apresentadas abaixo, numerando a Coluna II de acordo com a Coluna I.
Coluna I
(1) 2NaHCO3 →Na2CO3 + CO2 + H2O
(2) Mg(OH)2 + CO2→MgCO3 + H2O
(3) 2NH3 + CO2 →CO(NH2)2 + H2O
(4) NaHCO3 + HCℓ→NaCℓ + H2CO3
Coluna II
( ) Produção de substância usada como fertilizante.
( ) Ação do sal de fruta no estômago humano.
( ) Feitura do bolo de chocolate.
( ) Absorção
do gás de
ambientes
fechados.
A sequência correta, de cima para baixo, é:
Um belo exemplo de como a química está presente em todo lugar são os vaga-lumes, nos quais ocorre uma reação química do tipo bioluminescente que “acende” seus corpos, produzindo um lindo efeito com a participação do oxigênio que age como agente oxidante e, dessa forma, uma reação de oxidação-redução é responsável pela emissão de luz. Atente ao que se diz a esse respeito:
I. Em uma reação de oxidação-redução, todos os átomos passam por variação do número de oxidação.
II. Geralmente não há oxidação sem redução e vice-versa.
III. As reações de dupla troca são de oxidação-redução.
IV. As reações de combustão (queima na presença de oxigênio) são também processos redox.
V. Os termos oxidante e redutor costumam referir-se às espécies químicas, e não somente a determinado átomo.
Está correto o que se afirma somente em

