Questões de Vestibular Comentadas sobre química
Foram encontradas 1.418 questões

A função orgânica e a denominação dos compostos identificados como “I” e “II” estão corretamente indicadas na alternativa
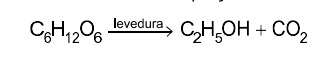
Leia o texto para responder às questões de 13 a 15. A produção de vinhos tem se desenvolvido nas últimas décadas em diversas regiões do Brasil. As características do vinho dependem de vários fatores, como condições de plantio (viticultura), processo de fermentação (vinificação) e compostos químicos participantes nessas etapas. Na viticultura, o óxido de cálcio (CaO) é usado para a correção do pH do solo, e o gesso agrícola ((CaSO4,2H2O é utilizado como fonte de cálcio e enxofre. Na vinificação, as uvas são prensadas e misturadas a leveduras, microrganismos que promovem a fermentação dos açúcares de acordo com a equação não balanceada:
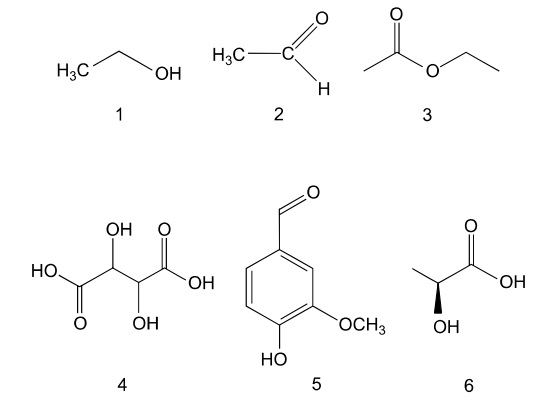
Durante o processo de vinificação, adiciona-se dióxido de enxofre (SO2,) para bloquear a ação de enzimas oxidantes. Alguns compostos orgânicos responsáveis pelo aroma e sabor do vinho estão representados pelas fórmulas estruturais de1 a 6.

Leia o texto para responder às questões de 13 a 15. A produção de vinhos tem se desenvolvido nas últimas décadas em diversas regiões do Brasil. As características do vinho dependem de vários fatores, como condições de plantio (viticultura), processo de fermentação (vinificação) e compostos químicos participantes nessas etapas. Na viticultura, o óxido de cálcio (CaO) é usado para a correção do pH do solo, e o gesso agrícola ((CaSO4,2H2O é utilizado como fonte de cálcio e enxofre. Na vinificação, as uvas são prensadas e misturadas a leveduras, microrganismos que promovem a fermentação dos açúcares de acordo com a equação não balanceada:

Durante o processo de vinificação, adiciona-se dióxido de enxofre (SO2,) para bloquear a ação de enzimas oxidantes. Alguns compostos orgânicos responsáveis pelo aroma e sabor do vinho estão representados pelas fórmulas estruturais de1 a 6.


O fenômeno climático das monções, que ocorre na Ásia, propicia a dispersão de poluentes que formam particulados, como o sulfato de amônio [(NH4)2SO4]. Esse composto é formado na atmosfera pela reação da amônia (NH3) com o dióxido de enxofre (SO2), de acordo com as equações:
SO2 (g)+ 1/2O2(g) → SO3 (g)
H2O (ℓ)+SO3(g) → H2SO4 (ℓ)
2NH3 (g) + H2SO4 (ℓ) → (NH4)2SO4 (s)
Considere os valores de entalpia-padrão de formação:
SO2 (g) 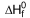 = -298 kJ/mol
= -298 kJ/mol
NH3 (g) 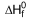 = -46 kJlmol
= -46 kJlmol
H2O (ℓ) 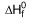 = -286 kJ/mol
= -286 kJ/mol
(NH4)2SO4 (s) 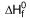 = -1179 kJ/mol
= -1179 kJ/mol
Com base nas informações apresentadas, pode-se afirmar
que a entalpia-padrão de reação de formação de 1 mol de
sulfato de amônio é
A chegada do homem à Lua, há 50 anos, possibilitou a coleta das rochas lunares, cuja análise permititu datar a idade do satélite natural da Terra com maior precisão. A técnica utilizada consistiu em determinar a proporção das quantidades do radioisótopo háfnio-182 e do isótopo estável tungstênio-182 presentes nessas rochas lunares.
O processo de decaimento radioativo do háfnio-182 apresenta uma etapa intermediária, na qual se forma o radioisótopo instável tântalo-182 que, por sua vez, decai para o tungstênio-182, de acordo com a equação:
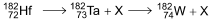
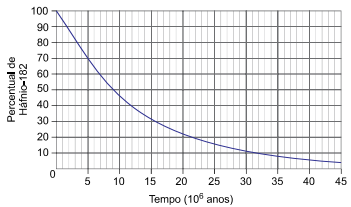
O decaimento radioativo do háfnio-182 resultando no tungstênio-182 em função do tempo ocorre de acordo com a curva apresentada no gráfico.
A emissão radioativa representada pela letra X na equação
de decaimento do háfnio-182 e a meia-vida desse radioisótopo em 106 anos são
Foi realizada uma demonstração experimental sobre a densidade de materiais e a polaridade de líquidos. Na figura, os recipientes 1 e 2 representam o comportamento de um polímero sintético sólido introduzido em dois líquidos distintos.
O recipiente 3 representa a mistura dos dois líquidos.
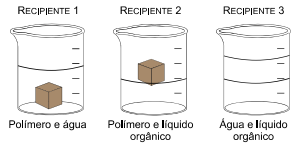
Com base na análise da figura, pode-se afirmar que a densidade do polímero é _________ do que a densidade do líquido orgânico, que é uma substância ____________ e forma uma mistura heterogênea com a água. No recipiente 3, a água é o líquido que constitui a fase __________ .
As lacunas são preenchidas, respectivamente, por:
O óxido nitroso é um gás empregado como analgésico em aplicações medicinais. Nesse óxido, o nitrogênio apresenta número de oxidação +1.
A fórmula molecular do óxido nitroso corresponde a:
Bicarbonato de sódio é utilizado como medicamento antiácido. Em presença de ácido, esse composto reage de acordo com a equação química a seguir:
NaHCO3 + H+ → Na+ + CO2 + H2O
Na reação completa de 16,8 g de NaHCO3 , a massa, em gramas, de CO2 produzida é igual a:
O radioisótopo 18F é empregado em exames de tomografia por emissão de pósitrons.
O número de nêutrons presentes nesse radioisótopo é igual a:
Uma indústria farmacêutica utiliza propanona como solvente na produção de vitaminas.
A propanona é obtida a partir da reação de oxidação de um composto orgânico com KMnO4 em meio ácido.
O composto orgânico usado como reagente nessa oxidação é nomeado por:
Um medicamento apresenta seu princípio ativo na concentração de 0,4 g/L. O volume de 10 mL desse medicamento foi injetado na corrente sanguínea de um paciente cujo volume de sangue é igual a 8 L.
Admitindo-se que todo o princípio ativo está dissolvido em 8 L de sangue, sua concentração, em g/L, é igual a:
O ácido pícrico, cuja molécula é representada a seguir, é utilizado no preparo de pomadas para o tratamento de queimaduras.
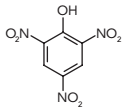
Esse composto pertence à função orgânica oxigenada nomeada como:
Para evitar a perda de potássio pelo organismo, sais desse metal são utilizados na formulação de diuréticos, medicamentos que levam ao aumento de volume de urina.
Um desses sais é o nitrato de potássio, que corresponde ao produto da reação de neutralização total entre:
A metformina, cuja fórmula estrutural é apresentada a seguir, é um medicamento utilizado no tratamento de diabete.
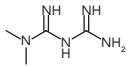
A fórmula molecular da metformina corresponde a:
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

Um estudante de química promoveu algumas reações obtendo os resultados de acordo com a tabela abaixo.
1 vol. de hidrogênio + 1 vol. de cloro → 2 vol. de gás clorídrico
2 vol. de hidrogênio + 1 vol. de oxigênio → 2 vol. de vapor d’água
3 vol. de hidrogênio + 1 vol. de nitrogênio → 2 vol. de amoníaco
Os resultados apresentados ilustram uma lei dos
gases que foi elaborada por
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA
