Questões de Vestibular de Química
Foram encontradas 1.430 questões
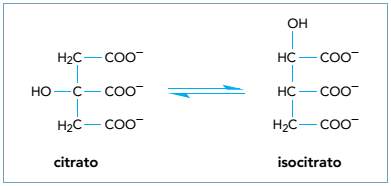
A isomeria plana que ocorre entre o citrato e o isocitrato é denominada de:
(www.agencia.fapesp.br. Adaptado.)
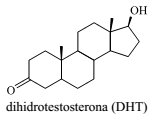
Sobre a DHT, cuja fórmula está representada, é correto afirmar que:
A sibutramina, cuja estrutura está representada, é um fármaco indicado para o tratamento da obesidade e seu uso deve estar associado a uma dieta e exercícios físicos.
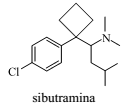
Com base nessa estrutura, pode-se afirmar que a sibutramina:
Na pele dos hipopótamos, encontra-se um tipo de protetor solar natural que contém os ácidos hipossudórico e nor-hipossudórico. O ácido hipossudórico possui ação protetora mais eficaz, devido à maior quantidade de um determinado grupamento presente em sua molécula, quando comparado com o ácido nor-hipossudórico, como se observa nas representações estruturais a seguir.
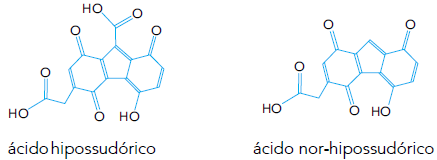
O grupamento responsável pelo efeito protetor mais eficaz é denominado:
Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais apresentados na tabela abaixo:
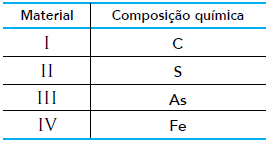
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte
número:
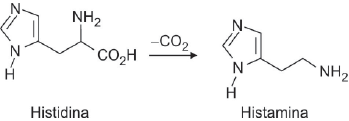
Nas estruturas de histidina e histamina, estão presentes as funções orgânicas:
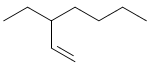
Segundo as regras da IUPAC, a nomenclatura do composto
representado acima é
A seguir está representada a estrutura do ácido fumárico.
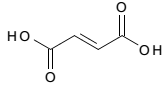
A respeito desse ácido, é correto afirmar que ele possui
Num processo de fissão nuclear, um nêutron colidiu com o núcleo de um isótopo do urânio levando à formação de dois núcleos menores e liberação de nêutrons que produziram reações em cadeia com liberação de grande quantidade de energia. Uma das possíveis reações nucleares nesse processo é representada por:
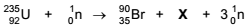
O produto X, formado na fissão nuclear indicada acima, é
um isótopo do elemento químico:
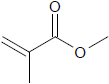
Essa substância possui fórmula molecular
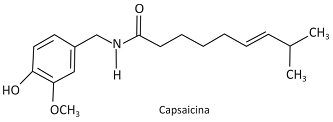
A seguir está representada a estrutura da dihidrocapsaicina, uma substância comumente encontrada em pimentas e pimentões.
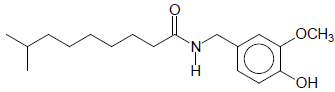
Na dihidrocapsaicina, está presente, entre outras, a função orgânica
A ardência provocada pela pimenta dedoͲdeͲmoça é resultado da interação da substância capsaicina com receptores localizados na língua, desencadeando impulsos nervosos que se propagam até o cérebro, o qual interpreta esses impulsos na forma de sensação de ardência. Esse tipo de pimenta tem, entre outros efeitos, o de estimular a sudorese no organismo humano.
Considere as seguintes afirmações:
I. Nas sinapses, a propagação dos impulsos nervosos, desencadeados pelo consumo dessa pimenta, se dá pela ação de neurotransmissores.
II. Ao consumir essa pimenta, uma pessoa pode sentir mais calor pois, para evaporar, o suor libera calor para o corpo.
III. A hidrólise ácida da ligação amídica da capsaicina produz um aminoácido que é transportado até o cérebro, provocando a sensação de ardência.
É correto apenas o que se afirma em
Soluções aquosas de ácido clorídrico, HCl (aq), e de ácido acético, H3CCOOH (aq), ambas de concentração 0,10 mol/L, apresentam valores de pH iguais a 1,0 e 2,9, respectivamente.
Em experimentos separados, volumes iguais de cada uma dessas soluções foram titulados com uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração adequada. Nessas titulações, a solução de NaOH foi adicionada lentamente ao recipiente contendo a solução ácida, até reação completa. Sejam V1 o volume da solução de NaOH para reação completa com a solução de HCl e V2 o volume da solução de NaOH para reação completa com a solução de H3CCOOH. A relação entre V1 e V2 é
Uma estudante de Química realizou o seguinte experimento: pesou um tubo de ensaio vazio, colocou nele um pouco de NaHCO3 (s) e pesou novamente. Em seguida,adicionou ao tubo de ensaio excesso de solução aquosa de HCl, o que provocou a reação química representada por
NaHCO3(S) + HCl(aq) → NaCl(aq) + CO2(g) +H2O(l)
Após a reação ter-se completado, a estudante aqueceu o sistema cuidadosamente, até que restasse apenas um sólido seco no tubo de ensaio. Deixou o sistema resfriar até a temperatura ambiente e o pesou novamente. A estudante anotou os resultados desse experimento em seu caderno, juntamente com dados obtidos consultando um manual de Química:

A estudante desejava determinar a massa de
I. HCl que não reagiu;
II. NaCl que se formou;
III. CO2 que se formou.
Considerando as anotações feitas pela estudante, é possível
determinar a massa de
O 1,4-pentanodiol pode sofrer reação de oxidação em condições controladas, com formação de um aldeído A, mantendo o número de átomos de carbono da cadeia.
O composto A formado pode, em certas condições, sofrer reação de descarbonilação, isto é, cada uma de suas moléculas perde CO, formando o composto B. O esquema a seguir representa essa sequência de reações:
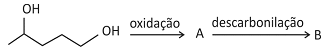
Os produtos A e B dessas reações são:
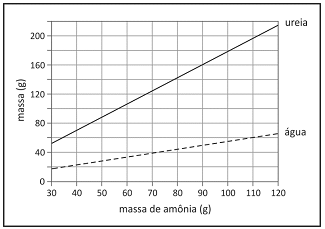
Amônia e gás carbônico podem reagir formando ureia e água. O gráfico ao lado mostra as massas de ureia e de água que são produzidas em função da massa de amônia, considerando as reações completas.
A partir dos dados do gráfico e dispondo-se de 270 g de amônia, a massa aproximada, em gramas, de gás carbônico minimamente necessária para reação completa com essa quantidade de amônia é
Um estudante utilizou um programa de computador para testar seus conhecimentos sobre concentração de soluções. No programa de simulação, ele deveria escolher um soluto para dissolver em água, a quantidade desse soluto, em mol, e o volume da solução. Uma vez escolhidos os valores desses parâmetros, o programa apresenta, em um mostrador, a concentração da solução. A tela inicial do simulador é mostrada a seguir.
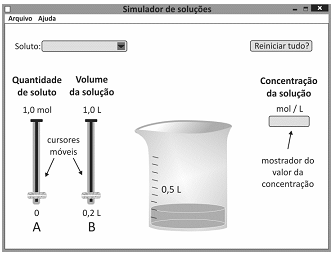
O estudante escolheu um soluto e moveu os cursores A e B
até que o mostrador de concentração indicasse o valor
0,50 mol/L. Quando esse valor foi atingido, os cursores A e
B poderiam estar como mostrado em
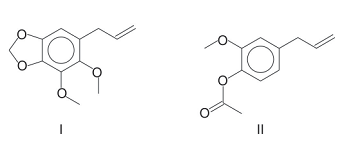
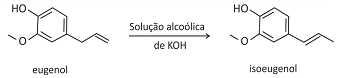
O eugenol, extraído de plantas, pode ser transformado em seu isômero isoeugenol, muito utilizado na indústria de perfumes. A transformação pode ser feita em solução alcoólica de KOH.
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
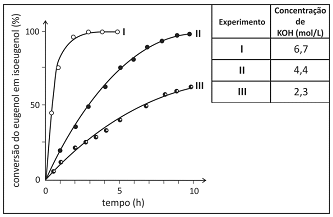
Analisando-se o gráfico, pode-se concluir corretamente que