Questões de Vestibular Comentadas sobre química
Foram encontradas 1.427 questões
Se a massa de CO2 produzida foi 13,9 g, a quantidade em mol de CO é:
4 NH3(g) + 5 O2(g) 4 NO(g) + 6 H2O(g) ΔH = -900KJ
Sobre a reação, é correto afirmar que:
B2O3 + 3Mg → 2B + 3MgO
Partindo-se de 262,5 g do óxido de boro em excesso de magnésio, obteve- se 33 g de B, o que significa que o rendimento percentual (%) da reação foi mais próximo de:
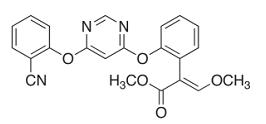
De acordo com a sua estrutura, é correto afirmar que azoxistrobina possui as seguintes funções orgânicas:
Sobre as características desse elemento e suas propriedades, em função da sua posição na tabela periódica, é correto afirmar que o iodo

Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.


Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.

Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.

Considerando essas informações, julgue os próximos itens.
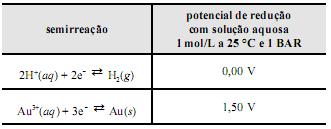

Considerando essas informações, julgue os próximos itens.

Considerando essas informações, julgue os próximos itens.

Considerando essas informações, julgue os próximos itens.

Considerando essas informações, julgue os próximos itens.
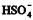 apresenta caráter anfótero em meio aquoso.
apresenta caráter anfótero em meio aquoso.
Considerando essas informações, julgue os próximos itens.

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

Com relação a esse assunto, julgue os itens de 98 a 101 e assinale a opção correta no item 102, que é do tipo C.
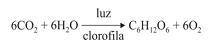
Sabendo-se que as entalpias padrão de formação do CO2, da água e da glicose são, respectivamente, iguais a - 427 kJ/mol, -280 kJ/mol e -1.036 kJ/mol, infere-se que essa reação é