Questões de Vestibular de Química
Foram encontradas 1.430 questões
causou a contaminação da água da região com iodo-131, um
material radioativo. O iodo é a matéria-prima principal que a
glândula tireoide utiliza para a formação de seus hormônios. A
exposição da glândula a altas concentrações desse isótopo pode
levar ao desenvolvimento de nódulos e de câncer da tireoide.
Mulheres grávidas, as que amamentam, fetos, bebês e crianças
constituem a população de maior risco, conforme demonstrado pela
experiência do acidente nuclear de Chernobyl. Para mitigar os
riscos de contaminação, o governo orientou os residentes de áreas
afetadas a ingerir, de forma profilática, iodeto de potássio (KI),
porque o organismo saturado com iodo estável não absorve o
radioativo.
Com relação ao tema acima, julgue os itens que se seguem.
causou a contaminação da água da região com iodo-131, um
material radioativo. O iodo é a matéria-prima principal que a
glândula tireoide utiliza para a formação de seus hormônios. A
exposição da glândula a altas concentrações desse isótopo pode
levar ao desenvolvimento de nódulos e de câncer da tireoide.
Mulheres grávidas, as que amamentam, fetos, bebês e crianças
constituem a população de maior risco, conforme demonstrado pela
experiência do acidente nuclear de Chernobyl. Para mitigar os
riscos de contaminação, o governo orientou os residentes de áreas
afetadas a ingerir, de forma profilática, iodeto de potássio (KI),
porque o organismo saturado com iodo estável não absorve o
radioativo.
Com relação ao tema acima, julgue os itens que se seguem.
causou a contaminação da água da região com iodo-131, um
material radioativo. O iodo é a matéria-prima principal que a
glândula tireoide utiliza para a formação de seus hormônios. A
exposição da glândula a altas concentrações desse isótopo pode
levar ao desenvolvimento de nódulos e de câncer da tireoide.
Mulheres grávidas, as que amamentam, fetos, bebês e crianças
constituem a população de maior risco, conforme demonstrado pela
experiência do acidente nuclear de Chernobyl. Para mitigar os
riscos de contaminação, o governo orientou os residentes de áreas
afetadas a ingerir, de forma profilática, iodeto de potássio (KI),
porque o organismo saturado com iodo estável não absorve o
radioativo.
Com relação ao tema acima, julgue os itens que se seguem.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

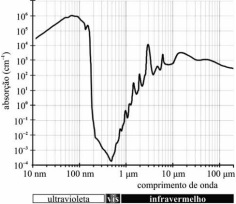
A figura I, acima, apresenta gráficos representativos da
absortividade de alguns gases da atmosfera e da atmosfera como um
todo, enquanto a figura II representa o espectro na faixa de luz
visível. Tendo como base essas figuras e considerando o número de
Avogadro igual a 6 × 1023 e a velocidade da luz igual a 3 × 108 m/s,
julgue os próximos itens.

A figura I, acima, apresenta gráficos representativos da
absortividade de alguns gases da atmosfera e da atmosfera como um
todo, enquanto a figura II representa o espectro na faixa de luz
visível. Tendo como base essas figuras e considerando o número de
Avogadro igual a 6 × 1023 e a velocidade da luz igual a 3 × 108 m/s,
julgue os próximos itens.
Sabendo-se que a coloração avermelhada de Marte decorre da presença de grande quantidade de óxido de ferro na superfície do planeta, então o espectro de absorção de luz desse composto pode ser corretamente representado de acordo com a figura abaixo.
Nos estados eletrônicos fundamentais, os elétrons dos íons K+ e Cl - ocupam o mesmo número de níveis de energia.
O átomo de potássio, por ser menor que o átomo de sódio (Na), apresenta a primeira energia de ionização maior que a do átomo de Na.
O Fe2O3 pode atuar na neutralização de uma solução ácida.
As moléculas de dióxido de carbono possuem ligações covalentes polares e, por isso, as interações entre as moléculas de CO2 na neve das calotas polares de Marte são do tipo dipolo permanente-dipolo permanente.
