Questões de Vestibular de Química - Relações da Química com as Tecnologias, a Sociedade e o Meio Ambiente
Foram encontradas 84 questões
Relacione corretamente as equações com as reações químicas do cotidiano apresentadas abaixo, numerando a Coluna II de acordo com a Coluna I.
Coluna I
(1) 2NaHCO3 →Na2CO3 + CO2 + H2O
(2) Mg(OH)2 + CO2→MgCO3 + H2O
(3) 2NH3 + CO2 →CO(NH2)2 + H2O
(4) NaHCO3 + HCℓ→NaCℓ + H2CO3
Coluna II
( ) Produção de substância usada como fertilizante.
( ) Ação do sal de fruta no estômago humano.
( ) Feitura do bolo de chocolate.
( ) Absorção
do gás de
ambientes
fechados.
A sequência correta, de cima para baixo, é:
Para aumentar o grau de conforto do motorista e contribuir para a segurança em dias chuvosos, alguns materiais podem ser aplicados no para-brisa do veículo, formando uma película que repele a água. Nesse tratamento, ocorre uma transformação na superfície do vidro, a qual pode ser representada pela seguinte equação química não balanceada:
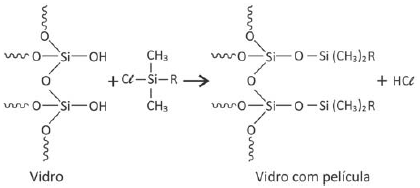
Das alternativas apresentadas, a que representa o melhor material a ser aplicado ao vidro, de forma a evitar o acúmulo de água, é:
Note e adote:
R = grupo de átomos ligado ao átomo de silício.
Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro (FeS2), sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo.
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:
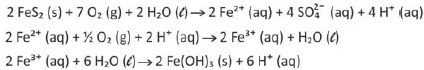
Considerando a equação química que representa a
transformação global desse processo, as lacunas da frase
“No intemperismo sofrido pela pirita, a razão entre as
quantidades de matéria do FeS2(s) e do O2(g) é __________,
e, durante o processo, o pH do solo __________” podem ser
corretamente preenchidas por
Dependendo do pH do solo, os nutrientes nele existentes podem sofrer transformações químicas que dificultam sua absorção pelas plantas. O quadro mostra algumas dessas transformações, em função do pH do solo.
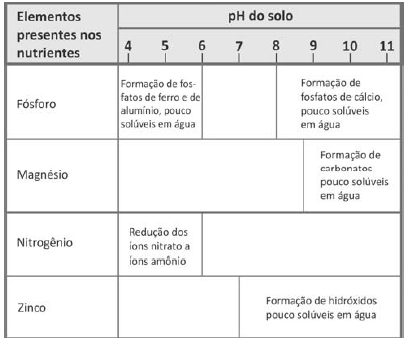
Para que o solo possa fornecer todos os elementos citados
na tabela, o seu pH deverá estar entre
A tira tematiza a contribuição da atividade humana para a deterioração do meio ambiente. Do diálogo apresentado, pode-se depreender que os ursos já sabiam

Os compostos (NH4)H2PO4 e NaHCO3 são usados em extintores como agentes de combate ao fogo. Quando lançados sobre uma chama, ocorrem as seguintes transformações:
(NH4)H2PO4 → NH3 + H3PO4
H3PO4 → polifosfato (viscoso)
NaHCO3 → CO2 + H2O + Na2CO3 (particulado).
No combate a todos os tipos de incêndio, a nuvem formada
de gás é importante, mas naqueles envolvendo materiais
sólidos, o depósito do material oriundo da transformação
do agente de combate sobre o combustível tem papel
decisivo. Assim, o agente (NH4)H2PO4 pode substituir o
NaHCO3 em qualquer situação, mas o contrário não é
verdade. Isso permite concluir que no combate ao incêndio
que envolve
A preocupação com a emissão de gases poluentes no meio ambiente está muito presente na indústria automobilística. Recentemente, uma das soluções encontradas para contornar esse problema nos veículos movidos a Diesel foi o desenvolvimento do Arla 32, uma solução de ureia em água, que atua nos sistemas de exaustão, de acordo com as equações químicas abaixo:
CO(NH2)2 + H2O → 2NH3 + CO2
4NH3 + 4NO + O2 → 4N2 + 6H2O
4NH3 + 2NO2 + O2 → 3N2 + 6H2O.
Com base nessas informações, pode-se afirmar
corretamente que a ação do Arla 32 leva a uma redução
Leia o texto e examine a tabela para responder à questão.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3000 °C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
Símbolo W
Número atômico 74
Número de massa 184
Ponto de fusão 3422 °C
Eletronegatividade (Pauling) 2,36
Densidade 19,3 g· cm–3

A ardência provocada pela pimenta dedoͲdeͲmoça é resultado da interação da substância capsaicina com receptores localizados na língua, desencadeando impulsos nervosos que se propagam até o cérebro, o qual interpreta esses impulsos na forma de sensação de ardência. Esse tipo de pimenta tem, entre outros efeitos, o de estimular a sudorese no organismo humano.
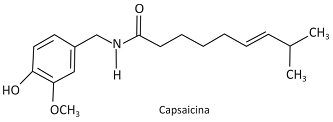
Considere as seguintes afirmações:
I. Nas sinapses, a propagação dos impulsos nervosos, desencadeados pelo consumo dessa pimenta, se dá pela ação de neurotransmissores.
II. Ao consumir essa pimenta, uma pessoa pode sentir mais calor pois, para evaporar, o suor libera calor para o corpo.
III. A hidrólise ácida da ligação amídica da capsaicina produz um aminoácido que é transportado até o cérebro, provocando a sensação de ardência.
É correto apenas o que se afirma em



